Preparado por: Dr. José Antonio Martínez Oyanedel
Departamento de Biología Molecular, Facultad de Ciencias Biológicas
Proyecto Docencia 97-003
CAPÍTULO 5: ESTRUCTURA TERCIARIA Y PLEGAMIENTOS
INTRODUCCIÓN
En el Capítulo 2 y 3 se introdujo las definiciones de
a-hélices y Hojas-b (Estructura Secundaria), y algunos "motivos" comunes compuestos por 2 ó 3 de estos elementos (Estructura secundaria superior). La Estructura Terciaria describe el plegamiento de la cadena polipeptídica para ensamblar los diferentes elementos de la estructura secundaria en un ordenamiento particular. Así como las hélices y las hojas son las unidades de la estructura secundaria, los dominios son las unidades de la estructura terciaria. El concepto de dominio tiene dos acepciones la estructural que se refiere a una porción de la proteína que es estable por si sola, es decir si se logra separar del resto de la proteína ella permanece con su plegamiento; la otra se refiere a los dominios funcionales que son las porciones de la proteína que esta involucrada en una determinada función y/o propiedad de la proteína y que no necesariamente se relaciona con una zona estabilizada por si sola, puede incluso corresponder solo a unos pocos aminoácidos. Los dominios estructurales generalmente se refieren a varias decenas de aminoácidos. En las proteínas multidominios, la estructura terciaria incluye el ordenamiento de los dominios unos respecto de los otros además del ordenamiento de la cadena polipeptídica dentro de cada dominio.Hay una pequeña y no bien definida distinción entre estructura secundaria superior "super-secondary structure" y estructura terciaria. La introducción del término estructura secundaria superior fue necesario ya que se encontró que dos o tres elementos de estructura secundaria con una cierta organización estaban presentes en varias proteínas diferentes, aún con secuencia aminoacídicas diferentes.
Note que algunas proteínas no consisten en un conjunto de motivos de estructura secundaria superior. Por ejemplo, las proteínas de la familia de las globinas consiste en 8 hélices en contacto, pero las hélices no se empaquetan con las que le son vecinas en la secuencia, con la excepción de las dos últimas las cuales forman un motivo de hélice-vuelta-hélice antiparalela.
Aunque el término "motivo" a menudo es usado para describir una estructura secundaria de orden superior, también puede ser usado para describir una secuencia de consenso identificada en varias proteínas más que una conformación tridimensional. Tal consenso en estructura primaria generalmente implica una similitud de estructura terciaria. Sin embargo debe recordarse que hay muchas secuencias de proteínas para las cuales se desconoce la estructura tridimensional, así que el término motivo se aplica estrictamente a estructura primaria mas que a nivel de estructura secundaria de orden superior.
TOPOLOGIAS HELICODALES
Helices Aisladas
Hay numerosos ejemplos de proteínas pequeñas ( o peptidos) los cuales consisten de un poco más que una simple hélice. Un ejemplo sorprendente es la Alameticina, un canal ionico gatillado por voltaje, que actúa como antibiótico peptídico.

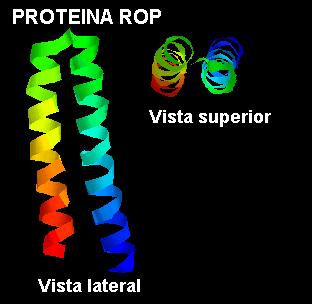
El empaquetamiento más simple para un dominio compuesto por dos hélices es que ellas se organicen en forma paralela conectadas por un "loop" corto. Esto constituye la estructura de una proteína pequeña (63 residuos de aminoácidos) que se une al ARN, Rop, la que se encuentra en ciertos plasmidios ( pequeñas moléculas de ADN de doble hebra circular que presentan bacterias y levaduras) y que esta involucrada en su replicación. En el esquema de más abajo se puede apreciar que se presenta una leve torsión entre las hélices.
El paquete de cuatro hélices
El paquete de cuatro hélices se encuentra en numerosas proteínas. En muchos casos las hélices son parte de una sola cadena polipeptídica, conectadas entre ellas por tres "loops". Sin embargo, la molécula Rop es un dímero de dos unidades de dos hélices, como se mostró mas arriba.
En las proteínas con paquete de cuatro hélices la interface entre las hélices consiste principalmente de residuos hidrofóbicos y los residuos polares se encuentran hacia la superficie interaccionando con el solvente, como lo señala el siguiente esquema:

Este ordenamiento es comparable al que podría esperarse en los dominios que atraviesan membranas. Las hélices centrales del centro de reacción fotosintético están ordenadas en una forma similar al paquete de cuatro hélices.
Otros ejemplos presentan empaquetamientos mas abiertos, como en la proteína que une esteroides: uteroglobina y la proteína de 17kDa de las células Clara.
La topología o disposición espacial de las cuatro hélices puede ser ordenadas en una forma simple arriba-abajo, como se indico anteriormente. En ejemplo es la miohemeritrina:
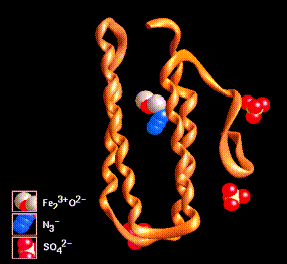
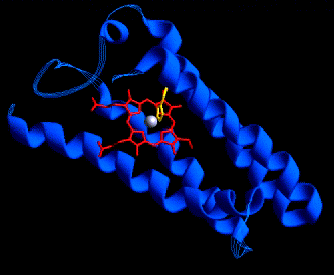
Otro ejemplo son los citocromos como el b652 y el citocromo c, que se muestra más abajo:
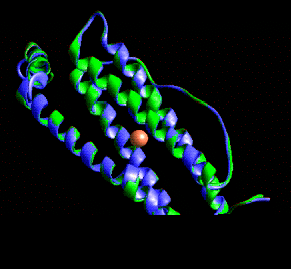
También es posible un ordenamiento más complejo como la ferritina:
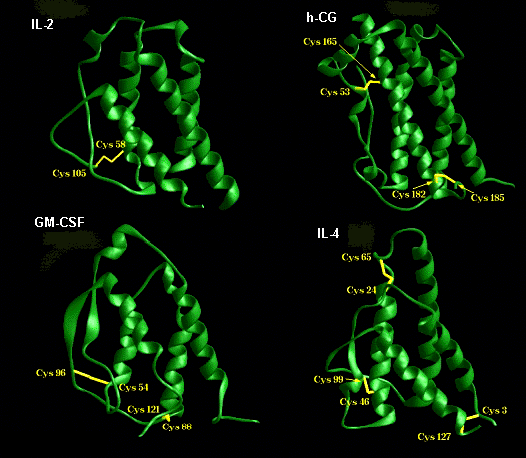
Citoquinas
Numerosas citoquinas consisten de un empaquetamiento de cuatro héilces. En el diagrama de más abajo se presentan Interleuquina 2, (IL-2), Hormona de crecimiento humana (h-CG), Factor estimulante de colonias de Granulocitos Macrófago (GM-CSF) e Interleuquina 4 (IL-4).
Dominios alfa que unen ADN
Los Factores de Transcripción son proteínas que se unen a regiones de control del ADN. Estas regiones están "corriente arriba" del gen estructural (la secuencia que realmente codifica para la proteína) cuya transcripción ellas regulan. Los factores de transcripción tienen un dominio que se une a ADN y un dominio que activa la transcripción. Un empaquetamiento de tres hélices forma la base del dominio de unión al ADN que se presenta en varias proteínas como por ejemplo la proteínas Homeodominio. Examinemos la estructura cristalina de un homeodominio unido al ADN:
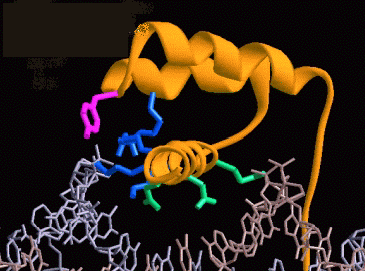
Aca se presenta la estructura del represor Cro del bacteriofago 434, unido a un trozo de ADN:
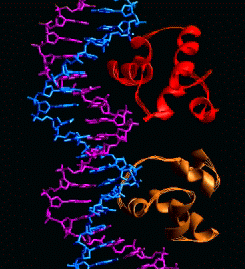
Globulinas
El plegamiento de las globulinas generalmente consiste de 8 a-hélices. Las dos hélices en el extremo de la cadena son antiparalelas formando un motivo hélice-vuelta-hélice, mientras que el resto de las hélices no constituyen ninguna estructura secundaria superior organizada. Estas hélices se empaquetan con grandes ángulos entre ellas, alrededor de 50º, lo que es mayor al ángulo entre las hélices antiparalelas, aproximadamente 20º.
En general, se han descrito 56 categorías de este plegamiento todo alfa, en la Base de datos Structural Classification of Proteins Database
Empaquetamiento Hélice-hélice
Cuando las hélices se empaquetan unas con otras, las cadenas laterales de la interface quedan internas, por lo que las dos áreas de la interface deben tener superficies complementarias. La superficie de una a-hélice puede ser esquematizada como una sucesión de hendiduras y montículos como el hilo de un tornillo, así cada 4º residuo forma parte del montículo ya que hay 3.6 residuos por vuelta. La dirección de elongación del montículo forma un ángulo de 26º con el eje de la hélice. Por lo mismo sí dos hélices se empaquetan de tan forma que en cada una los montículos calzan con las hendiduras de la otra, el ángulo esperado entre las dos es de 52º. En efecto, en la gráfica de distribución de este ángulo en una base de datos de las hélices empaquetadas juntas, se observa un agudo máxima alrededor de los 50º. Además de este tipo de montículos ya descrito, que se denomina i + 4, se pueden formar montículos con otro patrón de repetición de los residuos, tal como cada 3º o incluso cada residuo. Que tipo de montículo es usado en el empaquetamiento de dos hélices depende del tamaño y la conformación de las cadenas laterales en esta posición. El montículo i + 4, se cree que es el mas común debido a las cadenas laterales de los residuos en cada 4ª posición quedan mas cercanos que lsa cadenas en las 3ª posiciones, tal como lo indica la figura siguiente:
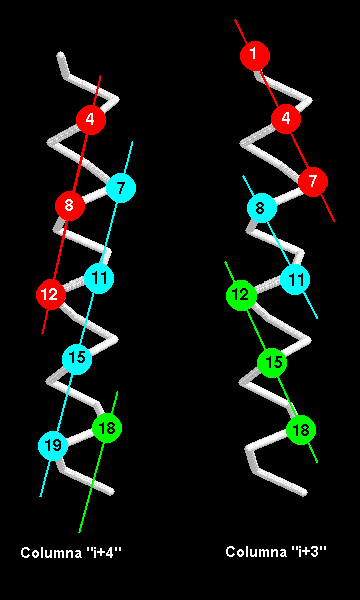
También se pueden presentar otros tipos de empaquetamientos: entre un montículo i + 4 y un montículo i + 3, donde hay un ángulo de 23º entre los dos ejes de las hélices, y un empaquetamiento entre un montículo i + 4 y un montículo i + 1, donde las hélices están separadas por 105º. Este modelo de montículos y hendiduras no describen todos los tipos de empaquetamientos que se presentan entre las hélices, hay algunos ejemplos con ángulos interaxiales no comunes. Por ejemplo, en el plegamiento de la mioglobina un par de hélices ( B y E) se empaquetan de tal forma que sus montículos se cruzan entre ellos gracias a un hueco formado por un par de residuos de Glicinas.
Se presenta más abajo el diagrama de los huecos en los montículos de la hélices B y E:
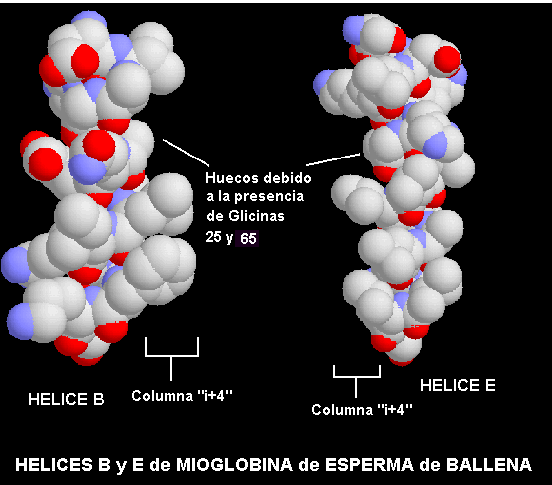
y en este esquema se presentan en un corte de un modelo las dos hélices empaquetadas entre si:.
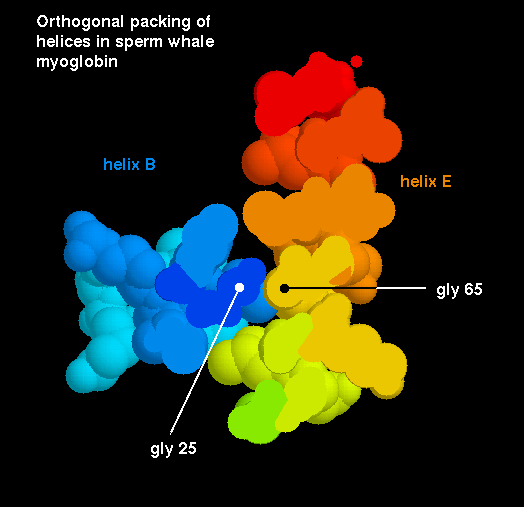
La distancia interaxial entre las hélices varia desde 6,8 a 12,0Å, siendo la media de 9,4Å; la interpenetración media de los átomos de la interface es de 2,3Å. Por lo tanto, son las cadenas laterales las que hacen contacto entre las hélices.
Algunos plegamientos Todo-alfa incluyen:
TOPOLOGÍAS TODO-
bLos plegamientos de proteínas que consisten casi enteramente de estructuras hojas beta se presentan completamente o mayoritariamente en el ordenamiento antiparalelo. Muchas de estos dominios antiparalelos consisten de dos hojas beta empaquetadas entre ellas, con los residuos hidrofóbicos formando la interface. Si se recuerda que las cadenas laterales de aminoácidos vecinos en las hebras beta, apuntan en direcciones opuestas, entonces esto significa que en tales estructuras la secuencia de aminoácidos alternara residuos polares e hidrofóbicos.
Sandwiches
b y Barriles bEl plegamiento de las inmunoglobulinas presenta las dos hojas betas empaquetadas entre ellas formando un " sandwich
b ".Sandwiches
b Alineados y ortogonalesEn las inmunoglobulinas y en la fibronectina tipo-3, las dos hojas están aproximadamente alineadas. En efecto, el ángulo medio entre las dos hojas es aproximadamente 30º (designado como -30º debido a que la hoja superior está rotada hacia la derecha respecto de la inferior). Las dos hojas beta generalmente son independientes respecto de que los residuos que las unen no forman hojas beta entre ellas, es decir no establecen interacciones puentes hidrógeno entre los átomos de la cadena principal. El ángulo entre las hojas está determinado por su torsión a la derecha. Los ángulos observados varían entre -20º y -50º; esto es debido a la variación en el grado de torsión. Además no siempre las cadenas laterales de la interface están alineadas.
El empaquetamiento ortogonal de la hojas consiste de hojas b plegadas sobre si mismas; las dos partes de las hoja forman un ángulo de -90º. Las hebras en una esquina o en dos esquinas opuestas por la diagonal continúan ininterrumpidamente desde una capa a la otra. El plegamiento al azar local en la esquina o una convexidad
b facilitan la torsión hacia la derecha. Estas torsiones son hacia la derecha debido a los valores de F y Y permitidos. La figura de más abajo ilustra este modelo: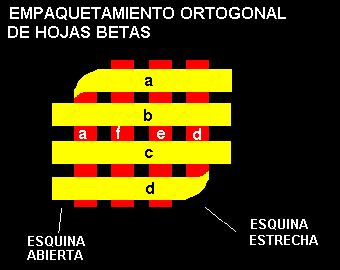
Solamente a lo largo de la diagonal las dos hojas hacen contacto. Cadenas laterales grandes en los "loops" llenan los espacios entre las esquinas abiertas.
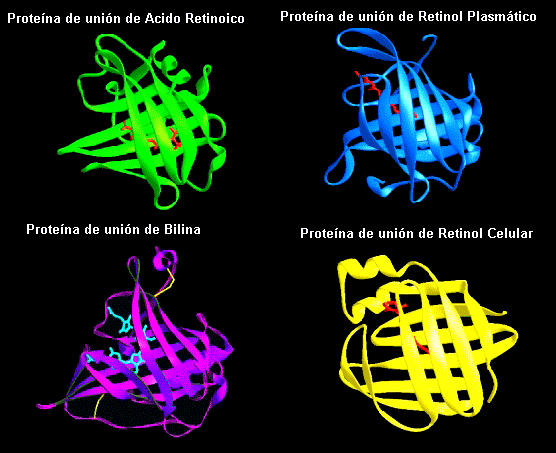
Esquemas de este tipo de plegamiento de hojas
b en la familia de la Lipocalinas, las cuales unen moléculas pequeñas entre las hojas del sándwich.Barriles
bAlgunos dominios de hojas
b antiparalelas son descritas con mas propiedad como Barriles b, por ejemplo la Estreptavidina y las Porinas. También existen algunos plegamientos intermedios entre estos dos plegamientos extremos Barril b y Sandwich b.
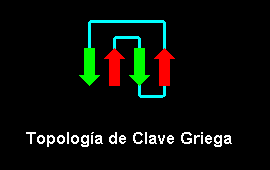
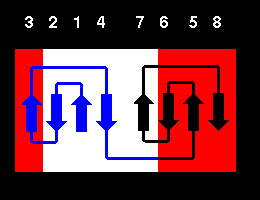
Topología de la Clave Griega
La topología más simple para una hoja antiparalela implica "loops" que conectan la hebras adyacentes, la forma en que se producen estas conexiones da lugar a algunas topologías.
La topología de la Clave Griega, denominada asi en comparación a las figuras o grecas que adornan las vasijas de arte griego. Este plegamiento implica la existencia de tres hebras antiparalelas conectadas por horquillas seguidas por una cuarta hebra que se encuentra vecina a la primera y esta conectada con la anterior, la tercera, por un gran "loop".
Los plegamientos incluidos en esta clase tienen entre 5 y 13 hebras, a continuacion se dan algunos ejemplos:
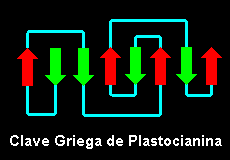
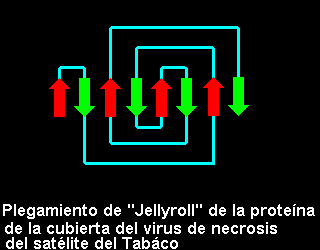
Topología del Remolino o Jellyroll
En 1981 se describió este plegamiento del Remolino o jellyroll, como el formado por un giro extra a plegamiento de Clave Griega. Si se consideran la hebras centrales como las que forman el motivo de Clave Griega, se puede observar en el esquema que hay dos pares de hebras adicionales que le llevan a conformar un remolino o espiral:
Además de los plegamientos descritos anteriormente, existen otros que son menos frecuentes: Turbina-b: Una molécula está compuesta por 4 de esta subunidades: Cada una es un superbarril de seis hojas antiparalelas de 4 hebras. La estructura global tiene la topología básica de arriba-abajo. Tréboles- b Este plegamiento tiene un eje de simetría de orden tres. Hélice-b : este plegamiento tan original fue descubierto recientemente. Las hebras se enrollan alrededor de la estructura describiendo una hélice.
TOPOLOGÍAS
a/bLa estructura mas regular y común de este dominio consiste de una repetición del motivo
b-a-b, de tal forma que la capa externa de la estructura está compuesta por a hélices empaquetadas contra un cuerpo central de hojas b. Este plegamiento es llamado a/b , o herida a b.Muchas enzimas incluidas casi todas la que participan en la Glicolisis, presentan este tipo de estructura
a/b. La mayoría de la proteínas a/b son citosólicas.El motivo
b-a-b es siempre con giro a la derecha y en las estructuras a/b siempre hay una repetición de este ordenamiento generando una secuencia b-a-b-a.....etc. Las hebras b son paralelas y están interaccionando mediante puentes de hidrógeno entre ellas, mientras que las a hélices son paralelas entre sí pero son antiparalelas a la hebras b. Así las hélices forman una capa que se empaqueta contra la hoja b. El motivo b-a-b-a-b a menudo presente en las proteínas que unen nucleótidos es llamado el plegamiento de Rossman, en homenaje a Michael Rossman, investigador en el área de estructura de proteínas.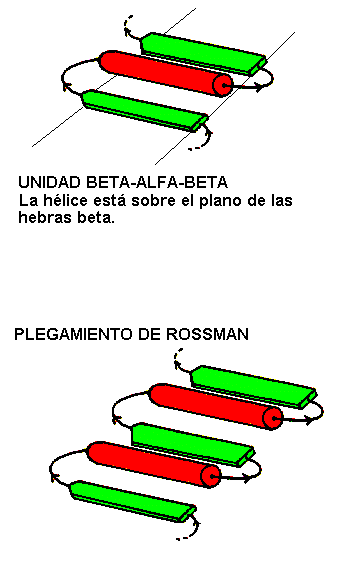
En 1981, Richardson denomino la estructura
a/b como "dominios a/b paralelos", para destacar el hecho que cada uno de los dos tipos de estructura secundaria forman un ordenamiento paralelo. Note que no hay razones obvias para que no se pueda esperar un dominio "todo alfa paralelo" (subunidad a-a-a), o un dominio "todo beta paralelo" (b-b-b), sin embargo estos no se encuentran. La marcada tendencia de las hélices para empaquetarse alineadas con las hojas se ha explicado por el modelo propuesto por Chothia de las Complementaridad de torsión. La torsión de las hojas hacia la derecha y la torsión a la derecha de las filas de los 4os residuos de las hélices ( el montículo i+4 del empaquetamiento de las hélices) tienen superficies complementarias cuando se alinean. Este modelo esta basado en las observaciones que aproximadamente el 90% de los residuos de la hélice que interaccionan con la hoja se encuentran separados por un número múltiplo de 4.
Herradura
a/bLa estructura del singular inhibidor de ribonucleasa de la placenta (Kobe, B. & Diesenhofer, J. (1993 ) Nature V.366, 751) lleva el concepto de repetición de la unidad
a/b al extremo. Esta es una proteína citosólica que une extremadamente fuerte a cualquier Ribonucleasa que pudiera escapar al citosol. Muestra como la imagen de más abajo una hoja b de 17 hebras paralelas curvadas en la forma de una herradura, con 16 a hélices empaquetadas contra la superficie externa de la hoja. No forma un barril aun cuando podría pensarse que si puede formarse. Las hebras están solo levemente inclinadas, siendo casi paralelas al eje central.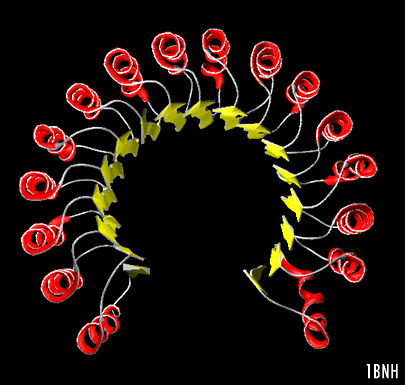
Barriles
a/bConsidere una secuencia de ocho motivos
b-a: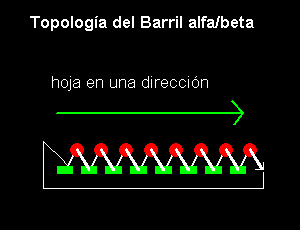
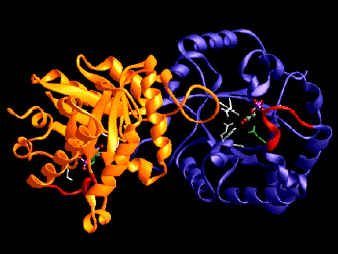
Si la primera hebra interacciona mediante puentes hidrógeno con la ultima, entonces la estructura se cierra sobre si misma formando una forma de barril. Esto es lo que se encuentra en la Triosa fosfato isomerasa, que se muestra mas abajo:
Note que las duelas del barril están inclinadas debido a la torsión de la hoja
b. Note también que hay cuatro capas en esta estructura. La dirección de la hoja no cambia, es en sentido antihorario. Tal estructura por lo tanto puede ser descrita como de sentido simple.En una estructura que es abierta y no cerrada como en el barril, las hélices podrían estar situadas solo sobre uno de las caras de la hoja, si la hoja no invierte su dirección. Por lo tanto las estructuras
a/b abiertas deben ser de sentido doble para cubrir ambos lados de la hoja.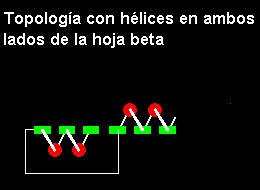
La cadena se inicia en el centro de la hoja y viaja hacia fuera, entonces regresa al centro vía un "loop" y viaja hacia fuera hacia el lado opuesto:
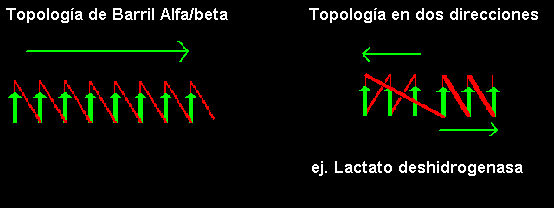
Las topologías de sentido doble, donde las hojas se inician en un extremo y continúan hacia adentro son observadas raramente
.
TOPOLOGÍAS ALFA+BETA
En esta clase se juntan todas los plegamiento que incluyen un alto número de elementos de estructura secundaria alfa y beta, pero estos elementos están mezclados, en el sentido que ellos no presentan la topología de alfa/beta. Esta clase de plegamiento es nominada como
a+ bEn esta clase se incluyen:
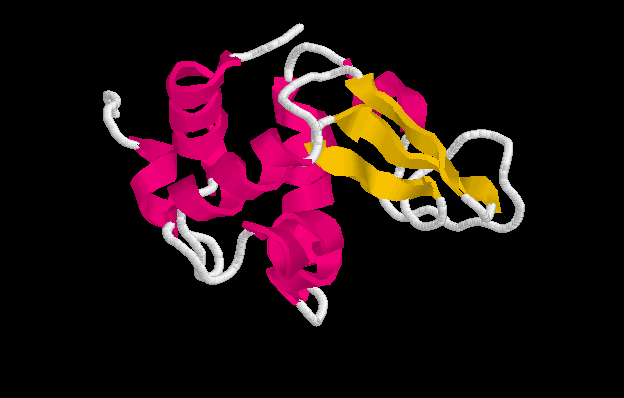
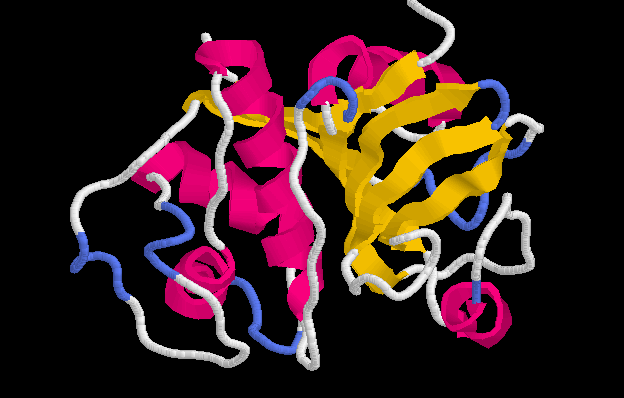
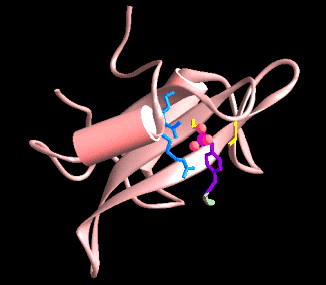
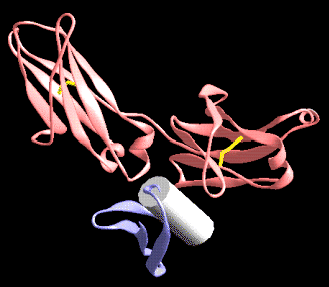
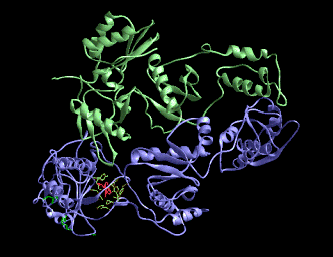
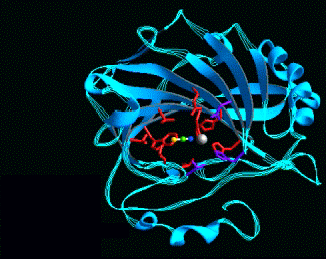
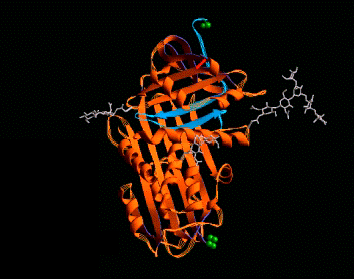
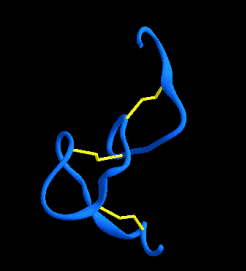
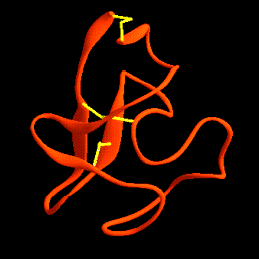
Plegamientos ricos en puentes disulfuros, proteínas pequeñas
A continuación se muestran unos pocos ejemplos de la familia de dominios ricos en puentes disulfuros. Los miembros de esta familia contienen un gran número de puentes hidrogeno que estabilizan su plegamiento, aún cuando este depende del alto número de puentes disulfuros.