Principios de Estructura de Proteínas
Preparado por: Dr. José Antonio Martínez Oyanedel
Departamento de Biología Molecular, Facultad de Ciencias Biológicas
Proyecto Docencia 97-003
CAPÍTULO 4: ESTRUCTURA SECUNDARIA SUPERIOR
Se ha observado que los elementos de estructura secundaria se combinan en ordenamientos de geometría específica conocidos como motivos de estructura secundaria superior. En el presente capítulo estudiaremos los motivos de estructura secundaria superior de no más de tres elementos. Los motivos de mayor numero de componentes se revisarán en el capítulo siguiente de plegamientos y estructura terciaria.
LA HORQUILLA BETA
La horquilla beta es uno de los motivos de estructura secundaria superior mas simple y el de mayor frecuencia y distribución en las proteínas globulares.

Ellas aparecen como un pequeño "loop" entre dos hebras betas antiparalelas consecutivas, que les confiere rasgos semejantes a las vueltas reversas. Las horquillas a diferencia de las vueltas no tienen un puente de hidrogeno entre los residuos i e i+3, además los carbonos alfa de dichos residuos están a mas de 7 Å.
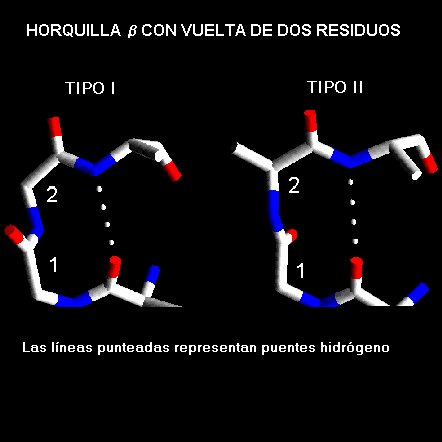
Las horquillas betas adoptan conformaciones especificas las cuales dependen de su longitud y la secuencia de aminoácidos que la forman. El 70% de las horquillas
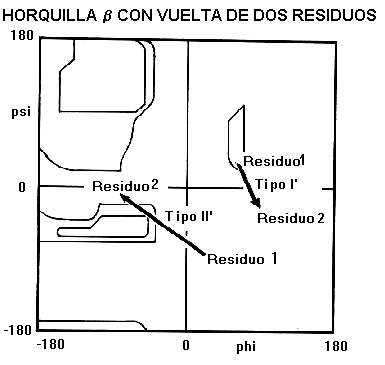
b son de menos de 7 residuos en longitud con una vuelta de dos residuos como su componente más notable. Estas horquillas b de dos residuos, como se les denomina, adoptan todas una de las conformaciones clásicas de las vueltas reversas, con una preferencia para los tipos I' y II'. Los del tipo I también ocurren pero con una baja frecuencia. Esto contrasta con las vueltas reversas donde los tipo I y II tienden a dominar. En las horquillas-b la vuelta del tipo I' tiene la torsión correcta para coincidir con la torsión de la hebra b, además por estudios de modelaje molecular se ha indicado que las vueltas, ya sea del tipo I o del tipo II no podrían mantener la distancia típica de las vueltas al conectar las hebras antiparalelas.Horquillas-
b con vueltas de dos residuosTipo I'
. El primer residuo en esta vuelta adopta la conformación de una a-hélice a la izquierda y por lo tanto presenta preferencia por residuos de glicina, asparragina o aspartato. Estos residuos pueden adoptar conformaciones con ángulo F positivo debido a la ausencia de la cadena lateral en el caso de la glicina y a la formación de un enlace puente hidrógeno entre la cadena lateral y la cadena principal en el caso de la asparragina y aspartato. El segundo residuo de este tipo de vuelta es siempre glicina ya que se requiere ángulo F y Y muy alejados de los valores permitidos en el gráfico de Ramachandran para aminoácidos con otras cadenas laterales. Sí se presentan otros tipos de aminoácidos podría presentarse impedimentos estéricos entre su cadena lateral y el oxígeno carbonílico del residuo precedente.Tipo II'. El primer residuo de estas vueltas tiene una conformación que solo puede se adoptada por Glicina. El segundo residuo se presentan preferentemente residuos polares como serina y treonina.
Horquillas-
b con vueltas de tres residuosNormalmente los residuos al final de las dos hebras solo forman un puente de hidrógeno como se muestra el esquema de mas abajo. Los tres residuos que intervienen en estas vueltas tienen diferentes preferencias conformacionales como se muestra en el gráfico de Ramachandran. El primer residuo adopta la conformación helicoidal
a-hélice hacia la derecha y el segundo residuos se presenta en la zona puente entre la zona helicoidal a y de hojas b. La Glicina, asparragina o aspartato se encuentran frecuentemente en la ultima posición ya que pueden adoptar ángulos F y Y cercanos a la conformación helicoidal a la izquierda.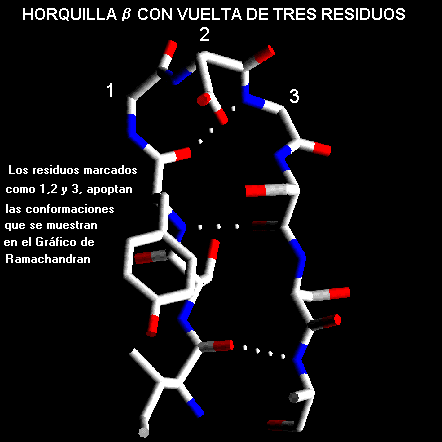
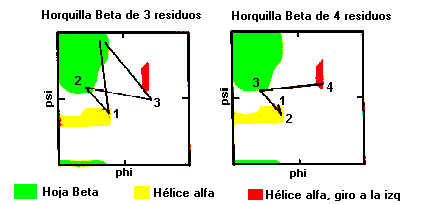
Horquillas-
b con vueltas de cuatro residuosEstas Horquillas son bastante comunes con los dos primeros residuos adoptando una conformación de
a-hélice. El tercer residuo tiene ángulo F y Y con valores que están en la región puente entre hélices y hojas b , el residuo final adopta una conformación de hélice con giro a la izquierda y es, por lo mismo generalmente, glicina, aspartato o asparragina.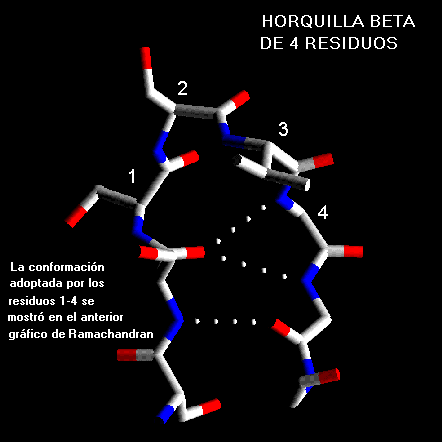
SERPENTEO BETA
Cuando se presentan varias hebras antiparalelas unidas por horquillas forman una estructura secundaria superior llamada Serpenteo beta
.
ESQUINAS-
bLas hebras-
b tienen una suave torsión a la derecha tal que cuando se empaquetan lado a lado para formar una hoja b , la hoja tiene una curvatura general hacia la izquierda. Las hebras que forman una horquilla b pueden acomodar un cambio de dirección de 90º, conocido como Esquina b . Las hebras en el lado del giro a menudo tienen una Glicina en esta posición mientras que la otra hebra puede tener un nudo-b. Esto último implica un único residuo en la conformación helicoidal a la derecha el cual rompe el patrón de puentes de hidrogeno de la hoja B. Este residuo también puede tener la conformación de hélice a la izquierda o de la zona conexión en el gráfico de Ramachandrán.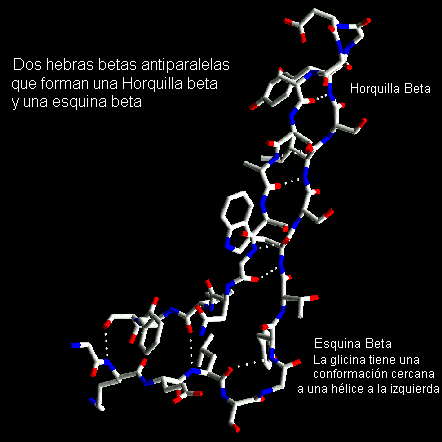
HORQUILLAS ALFA O HELICOIDALES
Una horquilla helicoidal u Horquilla-aa se refiere al "loop" que conecta dos segmentos helicoidales antiparalelos. Claramente mientras mayor es la longitud del segmento mayor es el número de posibles conformaciones. Sin embargo, para segmentos cortos hay un número limitado de conformaciones y para "loops" mas cortos, de dos o tres residuos, solo hay una conformación posible. Las hélices antiparalelas generalmente interaccionan mediante las cadenas laterales de residuos hidrofóbicos que se ubican en sus interfaces. Por lo tanto, los residuos hidrofóbicos se ubicarán adecuadamente en la secuencia, uno por vuelta de la hélice, para así generar el centro hidrofóbico. Se han analizado las conformaciones de las horquillas aa y a continuación se presentan algunos de los resultados.
La conexión más corta entre hélices involucra dos residuos los cuales están orientados aproximadamente perpendiculares al eje de la hélice. El análisis de estructuras conocidas muestra que el primero de estos residuos adopta ángulos F y Y en la zona puente o helicoidal del gráfico de Ramachandran. El segundo residuos siempre es glicina y está en una región del gráfico de Ramachandran con valores de phi positivo, la cual no esta permitido para los otros aminoácidos.
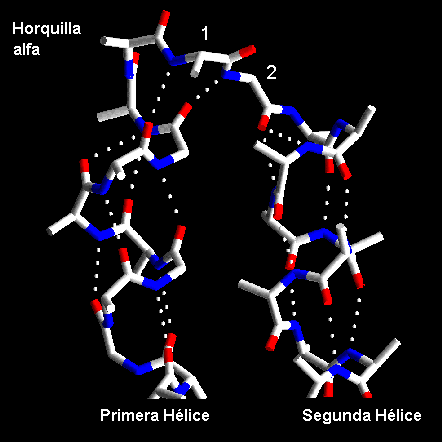
Los "loops" de tres residuos también tienen conformaciones preferenciales. El primer residuo ocupa la región puente del gráfico de Ramachandran, el segundo adopta la conformación helicoidal a la izquierda y el último residuo se presenta una conformación de estructura extendida o
b.Los "loops" de cuatro residuos adoptan una de dos posibles conformaciones. Una de ellas es similar al "loop" de tres residuos, descrito anteriormente, con la excepción que hay un residuo adicional, en la cuarta posición, en conformación extendida. La otra conformación implica los residuos con ángulos en la zona puente,
b, puente, y b , respectivamente.ESQUINAS
a-aPequeñas regiones que une dos hélices que se encuentran algo perpendiculares entre sí, se denominan como esquinas
aa. Se ha encontrado que para las esquinas aa más cortas, su primer residuo esta en una conformación de una hélice a la izquierda y los dos residuos siguientes en la conformación extendida. Esta conformación solo puede ser adoptada cuando las hélices forman una esquina con torsión a la derecha. Además, si las hélices están unidas para formar una esquina a la izquierda podría ocurrir impedimento estérico. Esto explicaría la escasez de las esquinas-aa en las estructuras de proteínas cuyas estructuras se conocen por cristalografía de proteínas.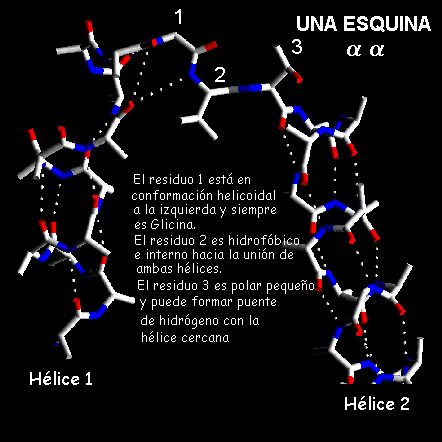
El residuo C-terminal de la primera hélice, el cual se encuentra en la conformación helicoidal a la izquierda, debe tener una cadena lateral corta para eliminar el impedimento estérico, por lo que generalmente se observan residuos de Glicina en esta posición. El primer residuo de la segunda hélice, el cual esta en la conformación helicoidal a la derecha, frecuentemente es un aminoácido con cadena lateral polar pequeña, generalmente serina o aspartato, los cuales pueden formar interacciones puente de hidrógeno con los grupos NH libres de la zona N-terminal de la segunda hélice. El residuo central de las esquinas
aa casi siempre es hidrofóbico ya que es interno e interacciona con cadenas laterales no polares en la zona donde los extremos de ambas hélices están en contacto.HÉLICE - VUELTA - HÉLICE
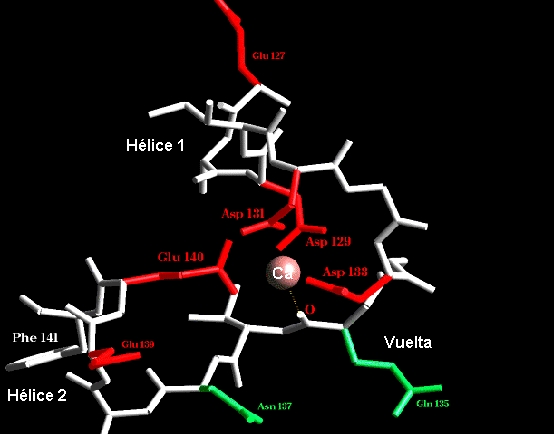
.El "loop" que conecta regiones helicoidales puede tener importantes funciones. Por ejemplo en la Parvalbúmina hay un motivo hélice-vuelta-hélice que aparece tres veces en la proteína. Dos de estos motivos están implicados en la unión de Calcio, con la participación carboxílicos de las cadenas laterales y carbonilos de la cadena principal. Este motivo ha sido llamado mano EF dado que se presenta entre las hélices E y F de la parvalbúmina. Parece ser que este constituye un motivo común, ya que este aparece en varias otras proteínas que unen calcio o son sensibles a este, tales como Calmodulina y Troponina C
Las manos EF están constituidas por una zona de 12 residuos que tienen residuos polares e hidrofóbicos en posiciones conservadas. Estas son cruciales para la ligazón del ion metálico y formación de un complejo estable. Glicina es invariante en la sexta posición del "loop" por razones estructurales. El ion Calcio es coordinado octahedricamente por cadenas laterales con grupos carboxílicos, grupos de la cadena principal y solvente.
Un motivo parecido, hélice-vuelta-hélice, es común a cierta proteína que une ADN. Este motivo se observó primeramente en proteínas que unen ADN, en procariontes, tales como el represor Cro del fago Lambda. Esta proteína es un homo-dímero cuyas subunidades poseen 66 aminoácidos. Cada subunidad esta constituida por una hoja-
b de tres hebras todas antiparalelas, con tres segmentos helicoidales insertados secuencialmente entre la primera y segunda hebras. Las dos subunidades de Cro están asociadas por la tercera hebra-b que interacciona formando una hoja de 6 hebras en el centro de la molécula. Estudios Bioquímicos y de mutagenesis han indicado que los residuos de la segunda hélice están implicados en la interacción con el ADN. Estudios de Modelaje Molecular indican que las segundas hélices de ambas subunidades podrían calzar e interaccionar con el surco mayor del ADN en la conformación B. Estas proteínas reconocen secuencias de bases que son palindrómicas, es decir, que poseen un eje de simetría interno, de 180º. Las dos hélices de reconocimiento de la proteína Cro también están relacionadas por un eje de simetría que pasa a través del centro de la hoja del dímero. Por lo tanto las hélices de reconocimiento del dímero Cro calza dentro del surco mayor del ADN e interacciona con cada una de las mitades del palindrome. De aquí, la segunda hélice del motivo hélice-vuelta-hélice tiene un papel importante en el reconocimiento del ADN mientras que el resto de la estructura sirve para mantener las dos hélices en la posición correcta para calzar con el surco mayor del ADN. Existen otras proteínas que unen ADN, con plegamientos generales muy diferentes, todas ellas mantienen el plegamiento del motivo hélice-vuelta-hélice esencialmente idéntico.
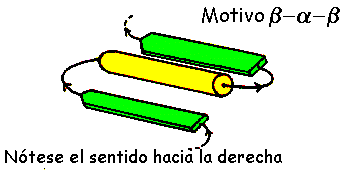
MOTIVO
b-a-bLas hebras-b antiparalelas pueden estar unidas por una pequeñas zona de la cadena polipeptídica formando una horquilla b. Por el contrario, las hebras-b paralelas están conectadas por una región larga de la cadena polipeptídica , la cual cruza la hoja b y frecuentemente contiene una zona helicoidal. Este motivo es llamado b-a-b y se encuentra en la mayoría de las proteínas que contienen una hoja b paralela. La región de la cadena que une las hebras a la zona helicoidal puede variar en longitud. El eje de la hélice es más o menos paralelo con la hebras y los tres elementos forman un centro hidrofobico. En ciertas proteínas el "loop" que une el extremo carboxilo de la primera hebra y el extremo amino de la hélice está implicado en la unión de ligandos o sustratos. El motivo b-a-b siempre tiene un plegamiento hacia la derecha como se muestra en la figura .