Preparado por: Dr. José Antonio Martínez Oyanedel
Departamento de Biología Molecular, Facultad de Ciencias Biológicas,
UNIVERSIDAD DE CONCEPCIÓN
Proyecto Docencia 97-003
CAPÍTULO 6: ESTRUCTURA CUATERNARIA
La estructura cuaternaria es el nivel de organización en el cual los unidades de proteínas en su estado ya plegado, es decir con su estructura terciaria se agregan para formar homo o hetero multímeros.
HETERO MULTIMEROS
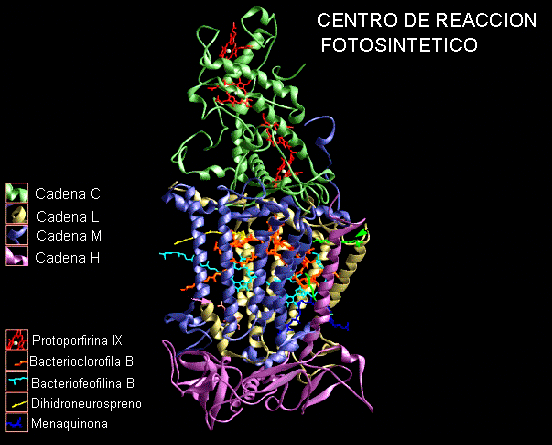
En este caso nosotros encontramos diferentes proteínas (cadenas polipeptídicas plegadas en su estructura terciaria) que se agregan para formar una unidad . Un buen ejemplo de esto es el fotocentro de reacción:

A menudo las diferentes cadenas tienen diferentes funciones, todas relacionadas, por ejemplo, una cadena es responsable de la unión, otra es responsable de la regulación y una tercera de la actividad enzimática. No es poco común encontrar más de una copia de una misma cadena en una proteína compleja. Un ejemplo de esto es la ATPsintetasa F1.

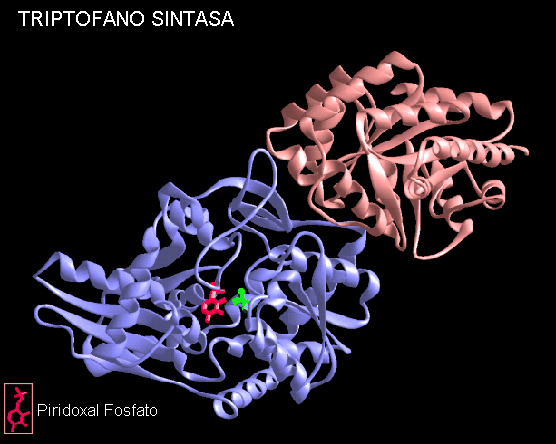
Dos pasos en la vía de biosíntesis del triptofano( en Salmonella typhimurium) están catalizados por la Triptofano sintasa, la cual consiste de dos cadenas separadas, designadas como a y b, cada una de las cuales es efectivamente una enzima diferente. La unidad biologicamente activa es un hetero-tetramero compuesto de dos subunidades a y dos subunidades b.
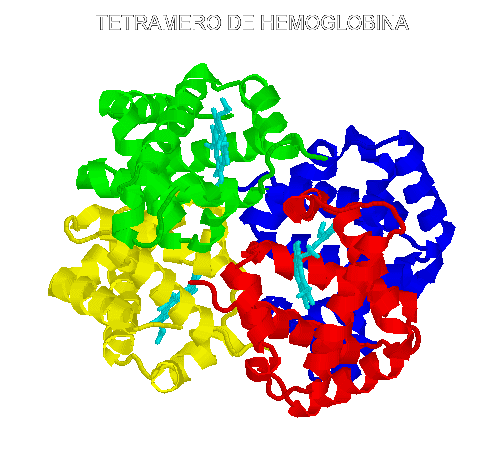
Se puede encontrar que a veces se asocian subformas de las misma proteína, que presentan solo leves diferencias. Por ejemplo la hemoglobina tiene tanto cadenas alfa como cadenas betas, las cuales se asocian para formar el heterodimero. Dos copias de este se asocian para formar el tetramero normal de la hemoglobina. Este es equivalente a tener un dimero de cadenas alfa asociado con un dimero de cadenas betas.
También puede presentarse que dos cadenas diferentes se asocien para formar una estructura secundaria superior mayor. Este es el caso de la lectina donde se forma una hoja beta muy grande por la asociación de diferentes cadenas proteicas:
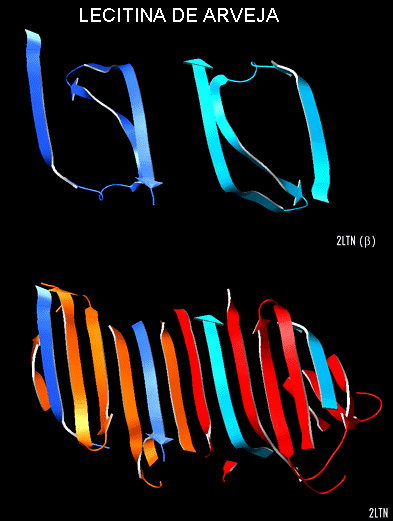
HOMO MULTIMEROS
Es muy común encontrar copias de la misma cadena asociadas no covalentemente. Estos complejos, son generalmente, aunque no siempre, simétricos. Debido a que las proteínas son inherentemente objetos asimétricos, los multimeros presentan casi siempre simetria rotacional alrededor de uno o mas ejes. La mayoría de las enzimas de las vías metabólicas se agregan en esta forma, formando dimeros, trimeros, tetrameros, hexameros, octameros decameros, dodecameros ( o aun incluso tetradecameros como en el caso de la chaperona GroEL).
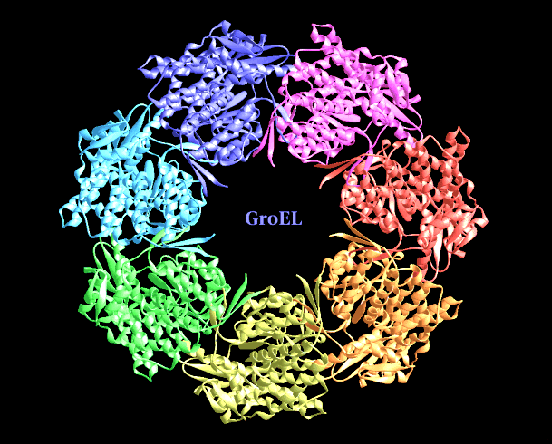
Se piensa que la razón de esta asociación es para adquirir propiedades regulatorias como cooperatividad y alosterismo. En efecto pequeños cambios conformacionales relacionados con la asociación de las subunidades que acompañan a la unión del sustrato y que modifican la eficiencia catalítica de la enzima. El ejemplo más estudiado es el "movimiento de exhalación" observado en el tetramero de la Hemoglobina.
Hay otros casos donde la dimerización es necesaria para realmente crear el sitio activo de la enzima. Por ejemplo en proteasa del virus HIV, la aspártico proteasa responsable de producir las diferentes proteínas a partir de la única cadena polipeptídica que el virus produce una vez que ha penetrado en la célula.
En algunos ejemplos, como en las citoquinas, la homotrimerización lleva a la formación del ligando funcional, el cual induce la unión de tres receptores formados por cadenas simples. Después de la unión estos receptores desencadenan señales intracelulares.

GRANDES AGREGADOS MACROMOLECULARES
La maquinaria molecular de la célula y sin duda de asociaciones de células, se apoya en agregados macromoleculares compuestos por ensambles de proteínas ácidos nucleicos y azucares. Algunos ejemplos son :
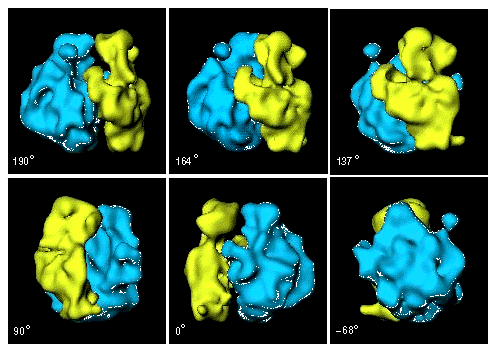
El esquema muestra varias vistas del ribosoma de procariontes, con sus subunidades pequeña (30S) en amarillo y su subunidad grande (50S) en celeste