Preparado por: Dr. José Antonio Martínez Oyanedel
Departamento de Biología Molecular, Facultad de Ciencias Biológicas
Proyecto Docencia 97-003
CAPITULO 3: CONFORMACION DE LAS CADENAS LATERALES
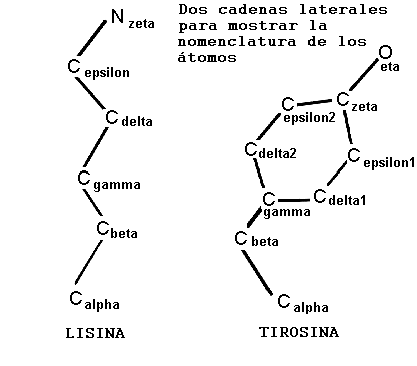
Las cadenas laterales de los aminoácidos se nombran utilizando el alfabeto griego desde el carbono quirálico, de acuerdo al siguiente esquema:

Loa ángulos de torsión se nombran como
c1(chi1), c2(chi2), c3 (chi3), etc., como se muestra en el esquema de más bajo: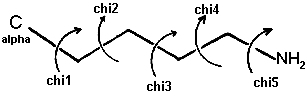
El ángulo
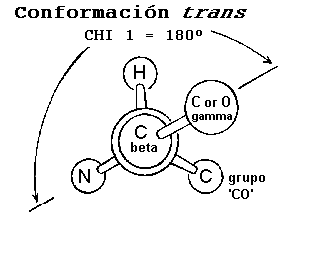
c1 es objeto de ciertas restricciones debido al impedimento estérico entre el átomo g de la cadena lateral y los átomos de la cadena principal. Las diferentes conformaciones de la cadena lateral como una función del ángulo c1, son referidas como: gauche(+), trans y gauche(-). Estas conformaciones se presentan en los esquemas siguientes, los diagramas se presentan como vistas a lo largo del enlace Cb-Ca.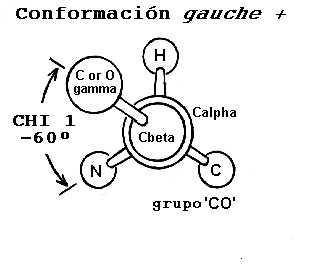
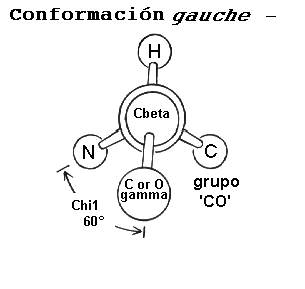
La conformación más abundante es gauche(+) en la cual el átomo
g está en posición opuesta al grupo carbonilo (grupo "CO"), del residuo, considerando una vista a lo largo del enlace Cb-Ca.La conformación trans es la segunda en abundancia, en esta conformación el átomo se encuentra en posición opuesta al nitrógeno de la cadena principal.
La conformación menos abundante es la gauche(-) la cual se presenta cuando la cadena lateral está en posición opuesta al hidrógeno sustituyente del C
a. Esta conformación es inestable debido a que el átomo g está en contacto estrecho con los grupos CO y NH de la cadena principal. La conformación gauche(-) es adoptada ocasionalmente por residuos de serina y treonina en una hélice donde el impedimento esterico es compensado por la formación de un puente de hidrógeno entre el oxígeno g y la cadena principal.Aunque las conformaciones gauche(+) y trans son adoptadas con una abundancia similar, la conformación gauche(+) tiende a dominar.
Los aminoácidos alifáticos que son bifurcados en C
b, es decir valina e isoleucina, no adoptan la conformación trans muy a menudo ya que esto implica que uno de los átomos Cg adquiera una posición gauche(-) inestable.En general, las cadenas laterales tienden a adoptar los mismos tres ángulos de torsión (+/-60 y 180º ) alrededor de
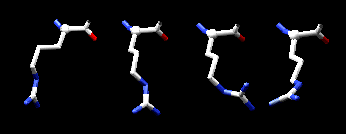
c2 ya que esto corresponde a conformaciones alternadas. Sin embargo, para residuos con un átomo g con una hidridización sp2 , tales como fenilalanina, tirosina, etc., c2 raramente adquiere el valor de 180º debido a que esto implicaría una conformación eclipsada. Para estas cadenas laterales el ángulo generalmente está alrededor de +/-90º ya que esto minimiza los contactos cercanos. Para residuos tales como aspartato y asparragina el valor del ángulo c2 está fuertemente influenciado por la capacidad de formar puente de hidrógeno de la cadena lateral y su ambiente. Consecuentemente estos residuos adoptan un amplio rango de ángulos c2 .Abajo se presentan una serie de conformaciones que puede adoptar la arginina.