Preparado por: Dr. José Antonio Martínez Oyanedel
Departamento de Biología Molecular, Facultad de Ciencias Biológicas
UNIVERSIDAD DE CONCEPCION
Proyecto 97-003
CAPITULO 1: LOS AMINOACIDOS
INTRODUCCION
En esta sección se revisarán las propiedades de los 20 aminoácidos naturales, entendiéndose por "aminoácidos naturales" aquellos que se encuentran formando parte de las proteínas genéticamente codificadas. Además de estos aminoácidos en los organismos vivos se encuentran y participan de los procesos biológicos otros aminoácidos diferentes de los antes mencionados.
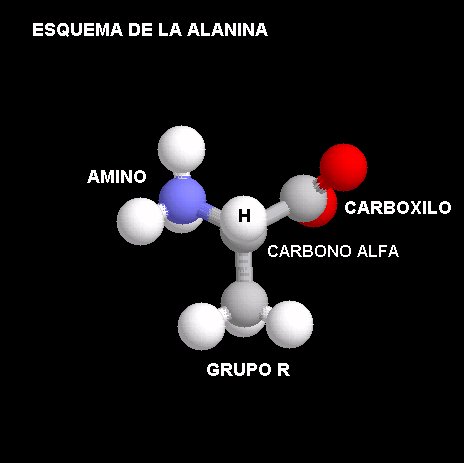
Los aminoácidos naturales se caracterizan por presentar un grupo amino y un grupo carboxilo unidos al carbono central llamado alfa, por lo que se denominan alfa aminoácidos. Este carbono posee además, como sustituyentes un átomo de hidrógeno y una cadena lateral, llamado grupo R, que en la naturaleza origina los 20 tipos de aminoácidos diferentes que pueden formar parte de las proteínas. Esto sustitución determina que este carbono alfa sea un centro quirálico, sus cuatro sustituyentes son diferentes, por lo tanto presenta actividad óptica rotatoria, es decir desvía el plano de la luz polarizada.

Los 20 aminoácidos naturales que forman parte de las proteínas son de la forma L. La forma L- corresponde a la forma que presenta igual configuracion que el L-glicerahdehido y no debe confundirse con levorotatoria que es el estereoisomero que rota el plano de luz polarizada a la izquierda. Solamente uno de los 20 aminoácidos no pertenece a la forma L, la Glicina. La glicina tiene como cadena lateral un átomo de hidrógeno, lo que quiere decir que el carbono alfa de este aminoácido tiene dos átomos de hidrógeno como sustituyentes de modo que es un carbono aquirálico o no-quiral. Por lo tanto no se le puede aplicar la terminología L- o D- .
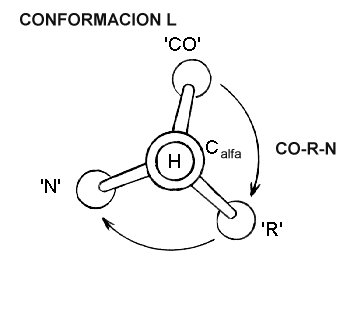
Para saber si la configuración de un aminoácido corresponde al isómero L- o D-, imaginemos que miramos a lo largo del enlace Hidrógeno-Carbono alfa de este como se presenta en el esquema de más abajo. En este esquema, si se comienza por el grupo carboxílico CO, se continua con el grupo R y finalmente el grupo NH2, en sentido horario ( giro en sentido de los punteros del reloj) se forma la palabra CORN, y el isómero corresponde al tipo L-; por el contrario si el movimiento es antihorario, el isómero corresponde al tipo D-. La nomenclatura L-/D- provienen del hecho que en la proyección de Fischer de este compuesto el grupo Amino está al lado izquierdo (Left ).
Los aminoácidos pueden ser divididos en varias clases diferentes basándose en sus propiedades fisicoquímicas de las cadenas laterales o grupos R.
El esquema de abajo muestra el código de colores que se utilizará en el presente capítulo para los diferentes tipos de átomos. En las estructuras no se presentan los átomos de hidrógeno para mayor claridad y debido a que estos no son localizados en la mayoría de las estructuras de proteínas obtenidas por difracción de rayos-X. En los diagramas de los aminoácidos estos se muestran como residuos, es decir el grupo carboxilo y el grupo amino tal como se encuentran en los polipeptidos.
La cadena lateral o radical o grupo R, dependiendo de los grupos funcionales que posea se clasifican en alifáticas, aromáticas, acídicas, básicas o neutras polares. Sin embargo, la Prolina tiene una estructura singular ya que su cadena lateral se cicla con el grupo alfa amino del mismo aminoácido, constituyendo un iminoácido.
AMINOACIDOS HIDROFOBICOS ALIFATICOS
Hay cuatro aminoácidos en esta clase, como se muestra a continuación. Sus cadenas laterales consisten de grupos metilénicos o metílicos. Estos aminoácidos, generalmente, están ubicados en el interior de las proteínas debido a su naturaleza hidrofóbica. Como se puede apreciar en el esquema todas las cadenas son bifurcadas a excepción de la Alanina. En el caso de la Val e Ile la bifurcación es cercana a la cadena principal y puede, por lo tanto, restringir la conformación de la cadena por impedimento estérico.

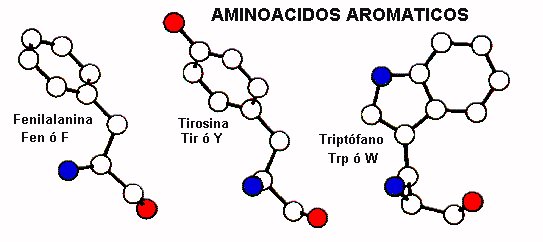
AMINOACIDOS HIDROFOBICOS AROMATICOS
De los tres residuos representantes de esta clase solo Fenilalanina es enteramente apolar. La tirosina posee un hidróxilo fenólico y el triptofano tiene un átomo de nitrógeno en su anillo indólico. Estos residuos casi siempre se ubican internalizados hacia el interior hidrofóbico de la proteína ya que su naturaleza es predominantemente no polar. Sin embargo, los átomos polares de la tirosina y el triptofano les permiten establecer interacciones puente hidrógeno con otros residuos o incluso con moléculas de solvente.
AMINOACIDOS POLARES NEUTROS
Como se puede ver más abajo hay varias cadenas alifáticas pequeñas que contienen grupos polares que son ionizables. La serina y treonina tienen grupos hidróxilos en sus cadenas laterales, estos grupos si poseen la geometría adecuada pueden formar puentes de hidrógeno con los átomos de la cadena principal. De esta forma pueden influir en la conformación, local del polipeptido, también se conoce que residuos como serina y asparragina pueden adoptar conformaciones que la mayoría de los otros aminoácidos no pueden tener. Los aminoácidos asparragina y glutamina poseen grupos amida en sus cadenas laterales los cuales generalmente están estableciendo puentes de hidrógeno con otros centros disponibles al interior de la proteína
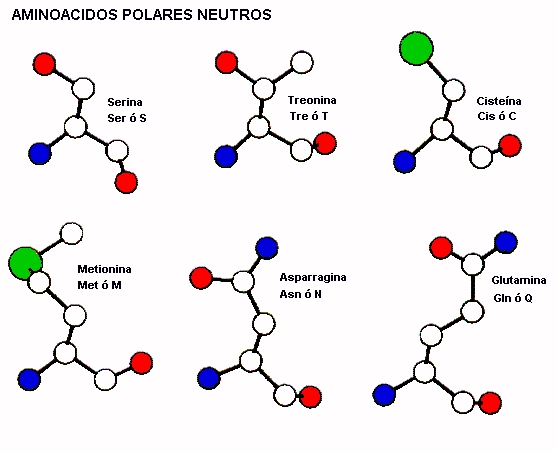
Hay dos aminoácidos que contienen átomos de azufre: metionina y císteina los cuales tienen un carácter marcadamente no polar. En efecto metionina podría ser clasificado como un residuo hidrofóbico ya que casi siempre esta asociado con el centro hidrofóbico de la proteína. La císteina es el único aminoácido que puede formar un enlace covalente con otro residuo de císteina y entrecruzar la cadena polipeptídica. Este puente disulfuro implica que se forma un enlace -S-S- entre dos císteina espacialmente adyacentes en la molécula de proteína. La gran fuerza cohesiva de ciertas proteínas, por ejemplo las queratinas de la concha de tortuga, puede ser atribuida al gran numero de puentes disulfuro que se establecen entre las moléculas de queratinas. Los puentes disulfuro son sensibles a agentes reductores los cuales convierten a ambos átomos a su forma reducida: grupos -SH. Las cisteinas frecuentemente forman parte de los sitios de unión de metales ya que su grupo sulfuro puede formar enlace covalente dativos con ciertos iones metálicos. Además, junto con serina se encuentran en los sitios activos de enzimas donde juegan un rol catalítico.
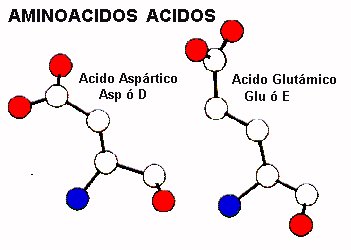
AMINOACIDOS ACIDOS
Dos aminoácidos, ácidos aspártico y glutámico, tienen un grupo carboxilo en su cadena lateral y por lo tanto están cargados negativamente a pH fisiológico. La fuerte naturaleza polar de estos residuos les significa que ellos muy a menudo se encuentran en la superficie de las proteínas globulares donde pueden interaccionar favorablemente con las moléculas de solvente. Estos residuos tambien pueden formar interacciones electrostaticas con aminoácidos cargados positivamente, es decir aminoácidos básicos. Aspartato y glutamato también pueden desempeñar roles catalíticos en el sitio activo de enzimas y formar parte de sitios de unión de iones metálicos, dada su alta capacidad de unión.
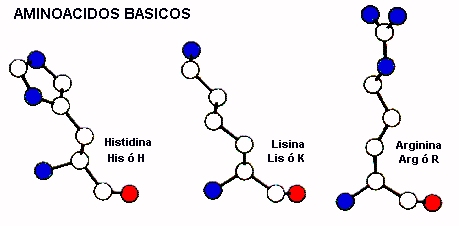
AMINOACIDOS BASICOS
De los aminoácidos con cadenas laterales básicas la histidina tiene el valor de pKa más bajo (alrededor de 6) y por lo tanto, a pH fisiológico se presenta como neutro. Este aminoácido se presenta muy frecuentemente en el sitio activo de enzimas ya que puede actuar muy eficientemente como catalizador acido-base. También puede actuar como ligando de iones metálicos en varias familias de proteínas . Las cadenas laterales de lisina y arginina son con un carácter básico más fuerte y por lo mismo se presentan cargadas positivas a pH fisiológico. Generalmente se presentan solvatadas, es decir en interacción con moléculas de solvente pero ocasionalmente se pueden presentar al interior de la proteína donde establecen interacciones electrostáticas con grupos cargados negativamente como Asp y Glu. Lisina y Arginina juegan un importante rol en las proteínas que unen aniones interaccionando electrostaticamente con los ligandos.
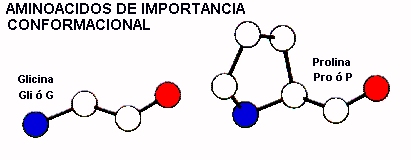
AMINOACIDOS DE IMPORTANCIA CONFORMACIONAL
La Glicina y la Prolina son aminoáciods singulares ya que estos parecen tener una influencia directa en la conformación de la cadena polipeptidica. La Glicina esencialmente debido a la falta de cadena lateral ( es solo un átomo de hidrógeno) puede adoptar conformaciones estericamente impedidas para los otros aminoácidos. Esto le confiere un alto grado de flexibilidad local a a la cadena. En consecuencia la glicina se encuentra frecuentemente en las regiones de vueltas donde la cadena polipeptidica debe formar horquilla para girar. La Glicina es muy abundante en ciertas proteínas globulares debido a su gran flexibilidad y por su pequeño tamaño lo cual permite que cadenas polipeptidicas adyacentes establezcan un contacto más estrecho. En contraste, la Prolina es el aminoácido natural más rígido ya que su cadena lateral se cicla y une covalentemente con el nitrógeno del grupo amino de la cadena principal.
La estructura tridimensional y la función de las proteínas son dependientes de la secuencia de aminoácidos de la cadena polipeptídica. A continuación se discuten algunas propiedades de los aminoácidos que tienen importancia en el contexto de la estructura de las proteínas:
A continuación se presenta una tabla con algunas de las propiedades de los aminoácidos naturales.
|
NOMBRE |
CODIGO 3 1 LETRA(S) |
ABUNDANCIA RELATIVA (%) E.C. |
PESO MOLECULAR |
Pka (lateral) |
VOLUMEN VdW (Å3) |
Cargado, |
|
|
Alanina |
ALA |
A |
13.0 |
71 |
67 |
H |
|
|
Arginina |
ARG |
R |
5.3 |
157 |
12.5 |
148 |
C+ |
|
Asparragina |
ASN |
N |
9.9 |
114 |
96 |
P |
|
|
Aspartato |
ASP |
D |
9.9 |
114 |
3.9 |
91 |
C- |
|
Cisteina |
CIS |
C |
1.8 |
103 |
86 |
P |
|
|
Glutamato |
GLU |
E |
10.8 |
128 |
4.3 |
109 |
C- |
|
Glutamina |
GLN |
Q |
10.8 |
128 |
114 |
P |
|
|
Glicina |
GLI |
G |
7.8 |
57 |
48 |
- |
|
|
Histidina |
HIS |
H |
0.7 |
137 |
6.0 |
118 |
P,C+ |
|
Isoleucina |
ILE |
I |
4.4 |
113 |
124 |
H |
|
|
Leucina |
LEU |
L |
7.8 |
113 |
124 |
H |
|
|
Lisina |
LIS |
K |
7.0 |
129 |
10.5 |
135 |
C+ |
|
Metionina |
MET |
M |
3.8 |
131 |
124 |
H |
|
|
Fenilalanina |
FEN |
F |
3.3 |
147 |
135 |
H |
|
|
Prolina |
PRO |
P |
4.6 |
97 |
90 |
H |
|
|
Serina |
SER |
S |
6.0 |
87 |
73 |
P |
|
|
Treonina |
THR |
T |
4.6 |
101 |
93 |
P |
|
|
Triptofano |
TRP |
W |
1.0 |
186 |
163 |
P |
|
|
Tirosina |
TIR |
Y |
2.2 |
163 |
10.1 |
141 |
P |
|
Valina |
VAL |
V |
6.0 |
99 |
105 |
H |
|