Estructura y propiedades del agua
El componente más abundante en la tierra es el agua. No es extraño que se constituya en el solvente más eficaz de los sistemas biológicos. Es un líquido a 25ºC y sus especiales propiedades como solvente aparecen como consecuencia de sus propiedades químicas. Lo más sorprendente de su comportamiento es la contracción de volumen que se observa al elevar la temperatura desde su punto de congelación 0ºC hasta 4ºC. Las principales propiedades del agua se muestran en la Tabla 1.1.
Tabla 1.1.
Propiedades del agua
Comparación con otros hidruros como NH3 y HF
|
Propiedad |
H2O |
NH3 |
HF |
H2S |
|
Composición |
2H, 1O |
3H, 1N |
1H, 1F |
2H, 1S |
|
T fusión(1Atm) |
0ºC |
-77.74ºC |
-92.3ºC |
-85ºC |
|
T ebullición |
100ºC |
-33.35ºC |
-60ºC |
|
|
Densidad al estado líquido |
0.958g/cm3 |
0.677 g/cm3 |
||
|
Viscosidad(15ºC) |
0.0028 poises |
0.025 poises |
||
|
Constante dieléctrica |
87.8(0ºC) |
22(33.4ºC) |
||
|
Tensión superficial |
58.85 erg/cm2(100ºC) |
|||
|
Conductividad equivalente |
6 x 10 -8ohm-1(25ºC) |
|||
|
Calor de vaporización |
9.72 kcal/mol |
|||
|
Producto iónico |
1.0 x 10 -14 |
|||
Datos extraídos de "Química Física Inorgánica", de S.M.Sienko y R.A.Plane. Edit. Reverté, Buenos Aires 1963.
1.1. La molécula de agua
El agua ha sido estudiada más extensamente que otros líquidos, pero sus propiedades microscópicas aun no se comprenden completamente. Esta dificultad surge de la dinámica de la red que forman las moléculas de agua. Por esta razón, los primeros estudios estructurales se realizaron sobre el agua en estado sólido y otras formas cristalinas densas, estables a altas presiones.
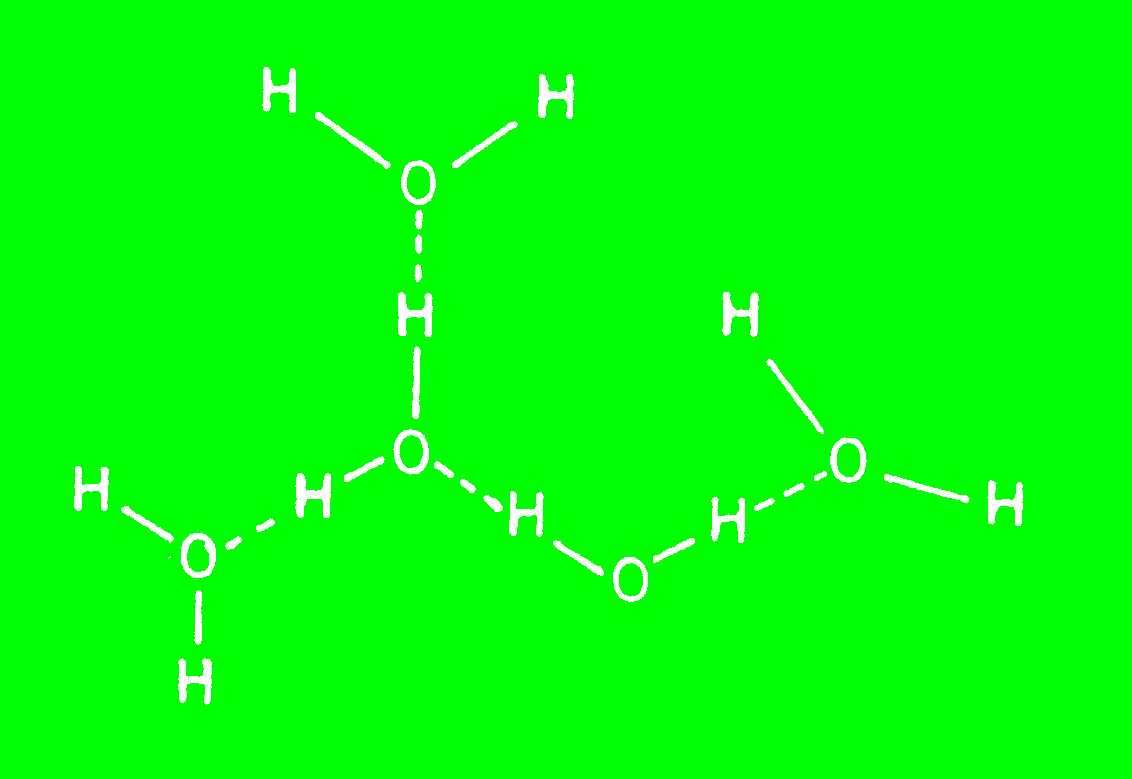
La composición química del agua es la de un hidruro de oxígeno. Todos los hidruros de elementos no metálicos más pequeños son gases a temperatura ambiente. El agua es la única excepción. Su existencia en fase condensada se debe a la fuerza de las uniones puente hidrógeno H-O--H, y a que cada molécula de agua puede formar cuatro de tales enlaces, dos en los cuales puede actuar como dador y dos en que actua como aceptor de electrones, como se observa en la Figura 1.1.

Figura 1.1. Tipos de puentes hidrógeno que pueden formar las moléculas de agua entre sí.
Así, cuando se proporciona calor a un volumen determinado de agua, simultáneamente se rompen las uniones hidrógeno y se eleva la temperatura. Esto es, parte del calor proporcionado se utiliza para aumentar la temperatura del sistema, el resto se utiliza para romper las uniones hidrógeno. Por esto se requiere más calor para elevar la temperatura del agua que de otros líquidos, cuyas moléculas no son capaces de formar este tipo de enlaces, y de ahí las propiedades que se exponen en la Tabla 1.1.
Una molécula de agua consta de un átomo de oxígeno y dos átomos de hidrógeno. El átomo de oxígeno contiene dos electrones más que el carbono. Tiene el orbital 1s completo, y de los cuatro orbitales híbridos sp3, dos contienen un par de electrones y los otros dos contienen un solo electrón. Los cuatro orbitales híbridos adquieren una disposición tetrahédrica como se observa en la Figura 1.2.
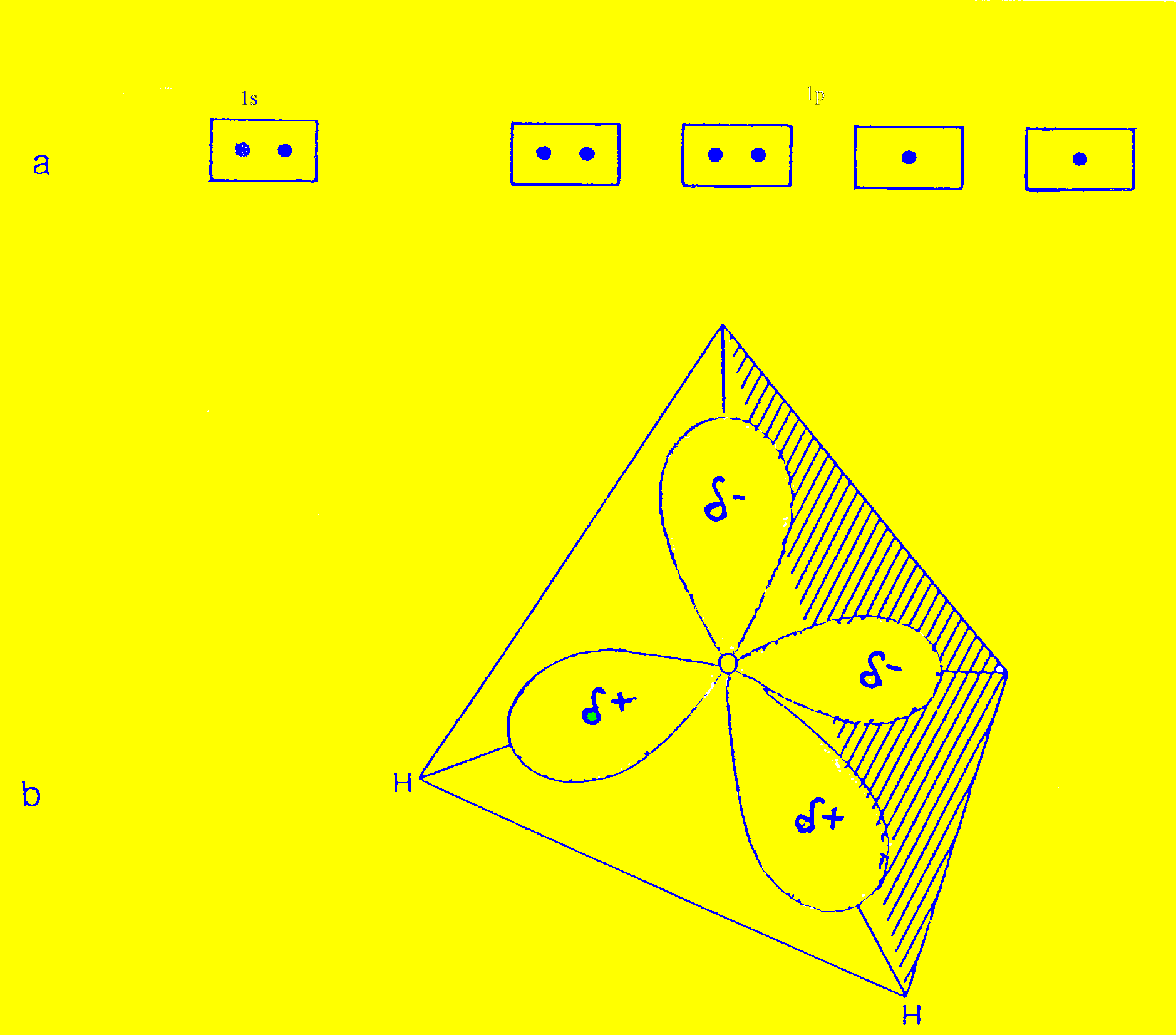
Figura 1.2. a) Configuración electrónica del átomo de oxígeno.
b) Estructura tetrahédrica de la molécula de agua.
Como vemos, hay dos orbitales sp3 que tienen un sólo electrón, por lo tanto para completar su par, podrían interaccionar con dos átomos de hidrógeno que contienen un solo electrón formando así una molécula de agua. Dos vértices están ocupados por átomos de hidrógeno y los otros dos por pares de electrones del oxígeno. Es necesario recordar su naturaleza tetrahédrica y el doble conjunto de pares de electrones del oxígeno para entender las propiedades del agua.
1.2. Hielo
Una de las propiedades más raras del agua es que en su estado sólido es menos densa que en el estado líquido (0.958 gr/cm3 a 0oC vs 1.00 gr/cm3 a 4oC). Esto se ve claramente cuando se observa al hielo flotando en el agua.
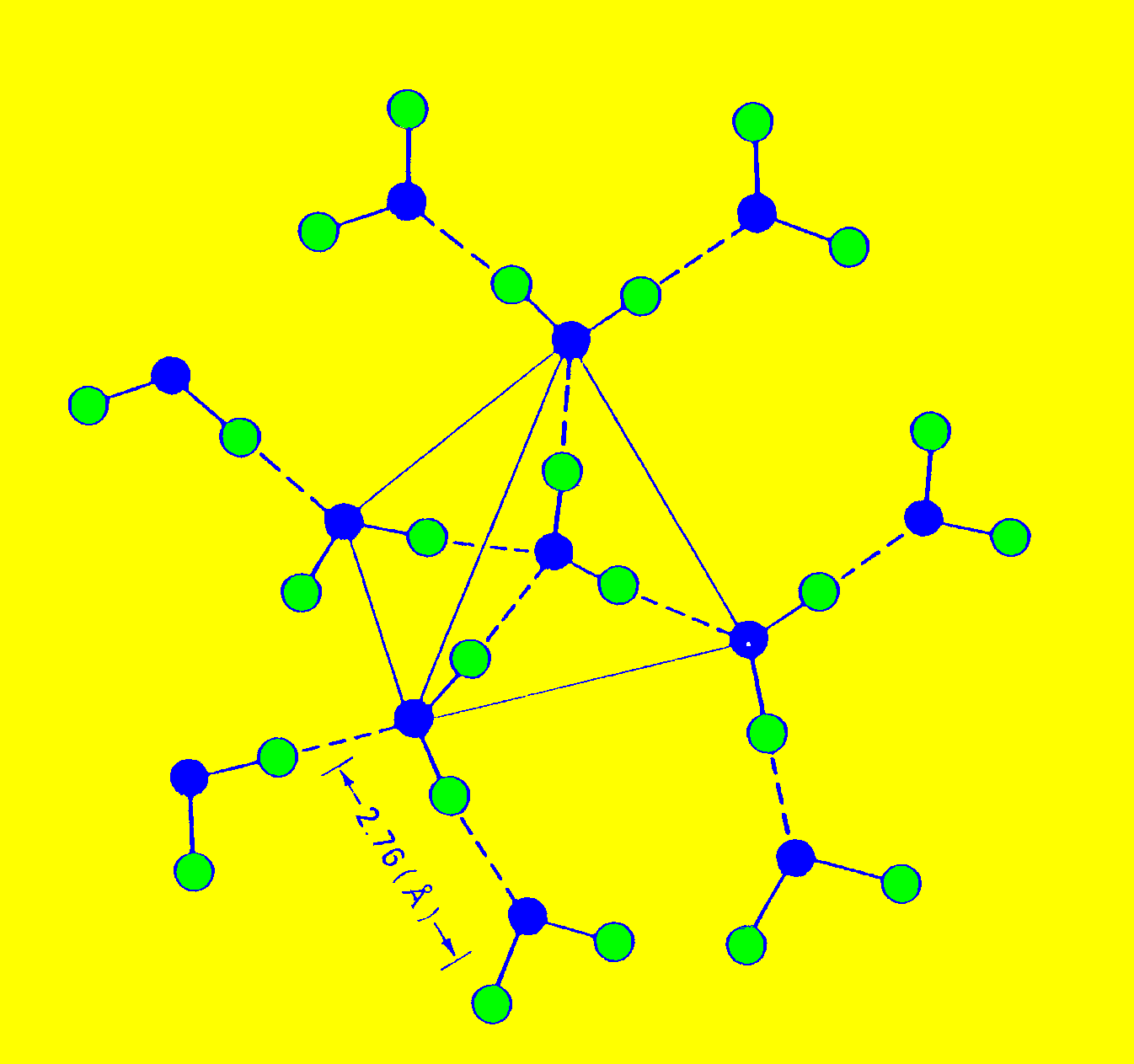
Figura 1.3. La relación espacial entre una molécula de agua y sus cuatro vecinas más próximas en el hielo.
La técnica de difracción de rayos X ha permitido demostrar que existe la estructura tetrahédrica del agua y cómo este ordenamiento se extiende a toda la masa de agua considerada. Se ha encontrado además estructuras trimérica, pentaméricas y recientemente se ha comprobado la existencia de estructuras hexaméricas estables.
Debido a los enlaces puente hidrógeno, el volumen que ocupa el agua en el hielo, es mucho mayor que el que ocuparía si no formasen este tipo de enlaces, ya que impiden que las moléculas individuales de agua se acerquen mucho unas a otras.
Si no existiesen puentes hidrógeno, la densidad del hielo sería 1.5 veces mayor. En cristales normales existe espacio libre que permite al hielo bajo presión, formar estructuras más densamente empaquetadas, pudiendo llegar hasta densidades de 1.66 gr/cm3. En estos casos, las moléculas de agua retienen su estructura básica, pero algunos enlaces hidrógeno se distorsionan (H-O--H no es lineal). Así, las moléculas de agua pueden acercarse mucho más unas a otras.
Este mismo tipo de distorsión sirve para dejar espacio a moléculas de soluto en hidratos cristalinos de solutos no polares y para acomodar regiones no polares de las macromoléculas biológicas como se verá más adelante; en estos casos, la distorsión servirá para dejar espacio a las moléculas de soluto, en lugar de moléculas de agua no enlazada.

Figura 1.4. Esquema de una red cristalina similar a la del hielo, en la que se observa el supuesto efecto de iones en la estructura hipotética del agua.
a) red no perturbada,
b) efecto de un ión positivo de coordinación tetrahédrica con el agua, se observan la ausencia de dos uniones hidrógeno,
c) efecto de un ion negativo tetrahédrico en la red cristalina del agua. Se observan 4 ausencias.
(Figura extraída de "Introducción a la Biofísica del agua" de J. Raul Grigera. Editorial EUDEBA Buenos Aires.
1.3. Agua líquida
El estado en que el agua se encuentra dentro de la célula ha sido objeto de muchos estudios recientemente. Al parecer, las moléculas de agua se encuentran mucho más asociadas de lo que puede imaginarse, sin embargo ésto puede sólo extrapolarse a partir de las concentraciones de moléculas existentes dentro de la célula. Aunque existe mucha información sobre la estructura del hielo, no ocurre lo mismo con las etapas de organización parcial del agua como solvente biológico.
La estructura del agua líquida puede analizarse examinando lo que ocurre cuando el hielo se funde. Cuando esto ocurre, el orden local de las moléculas de agua se pierde, ya que ocurre ruptura de enlaces puente hidrógeno. Si el orden de corto alcance se pierde, también se pierde el orden de largo alcance. A medida que la temperatura aumenta, también aumenta el número de moléculas de agua vecinas, la estructura se hace más compacta. La estructura del hielo se mantiene pero en zonas restringidas, que alcanzan distancias de hasta 10Å alrededor de cada molécula de agua. En el agua líquida se espera encontrar arreglos de hasta 12-13 moléculas de agua.
Es posible que coexistan en el agua líquida diferentes formas estructurales. Esta propiedad, que refleja la posibilidad que los enlaces puente hidrógeno se formen y rompan rápidamente(vida media = 10-11 seg), hace que su viscosidad sea también baja; ésto resulta de mucha importancia, considerando que el agua es el solvente de los sistemas biológicos y permite la vida en la forma que conocemos.
Como en este solvente se encuentran inmersos todos los compuestos que forman los organismos vivos, es necesario evaluar cómo se ven afectados en sus interacciones. Este efecto se denomina hidratación, o la capacidad de las moléculas de agua para organizarse alrededor de un soluto. Para el análisis se considerará dos casos que constituyen los extremos de lo que ocurre en los sistemas biológicos:- la hidratación de sustancias polares o iónicas y - la hidratación de sustancias no polares.
1.4. Hidratación de sustancia polares o iónicas
Al agregar una sal (NaCl, MgSO4, etc) al agua líquida, se produce una alteración en el orden espacial de las moléculas de agua; las propiedades individuales de cada substancia no sólo se suman para dar las propiedades de la solución, si no existe una interacción definida con ellas. Para explicar estas interacciones consideremos la Figura 1.5 que supone que un catión se está hidratando. La capa de moléculas de agua inmediatamente adyacente al catión es la que se conoce como Primera capa de hidratación (I). El número de moléculas de agua(las flechas indicando una dirección sólo indican una grado de orden) asociadas a esta capa dependerá del tipo de ión que se esté hidratando, así para el Na+ y el K+ alcanza sólo a 6. Esta capa se caracteriza por ser muy organizada y se mueve con el ión. La Segunda capa de hidratación (II) es la más desorganizada ya que está continuamente intercambiando moléculas de agua entre la primera capa y la masa de líquido (III), por lo que se considera una zona de transición entre ambas (vida media = 10-6 - 10-7 seg). Al crearse esta segunda capa de hidratación desorganizada por acción de un catión en este caso particular, se facilita elevar la temperatura de la solución, ya que esta vez será menor la cantidad de calor necesaria para romper los puentes hidrógeno y mayor el calor destinado a aumentar la temperatura. Podemos decir que la hidratación de sustancias iónicas aumenta la entropía, esto hace que sea termodinámicamente favorable la formación de soluciones de compuestos iónicos. En la célula, la existencia de iones presupone la existencia de agua de hidratación.
La capacidad de cada ión de disminuir la movilidad de las moléculas de agua que la rodean, puede medirse indirectamente, usando relaciones como el coeficiente de viscosidad (h) del agua pura con respecto a la de la solución del ion considerado. Aquellos iones que sean más capaces de alterar la red de puentes hidrógeno de las moléculas de agua, alterarán más la viscosidad y esto puede ser una medida del cambio en la organización de las moléculas de agua. La figura 1.4 permite observar las distorsiones producidas por iones positivos y negativos.
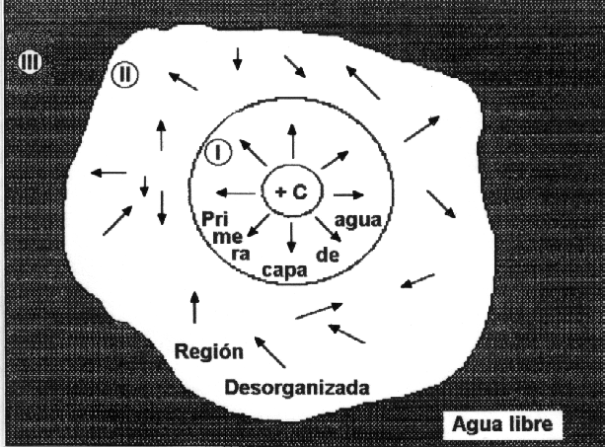
Figura 1.5. Organización del agua alrededor de una molécula polar. Las flechas esquematizan el orden en las moléculas de agua que rodean al ion.
1.5. Hidratación de substancias no polares
En muchos aspectos, la hidratación de grupos no polares o hidrofóbicos es diferente de la hidratación de compuestos iónicos o polares. Las sales inorgánicas tienden a desordenar parcialmente la estructura del agua por la hidratación. Los compuestos no polares producen el efecto opuesto. Al agregar una sustancia hidrofóbica, las moléculas de agua vecinas se organizan alrededor de la molécula apolar formando un clatrato, un esquema del cual se muestra en la Figura 1.6. En este proceso las moléculas de agua rompen los puentes hidrógeno originales para formar nuevos en su estructura. La molécula apolar aparece formando un hueco en la estructura masiva del agua, ya que las moléculas de agua debido a su estructura electrónica, prefieren interaccionar entre ellas y no con el soluto apolar.
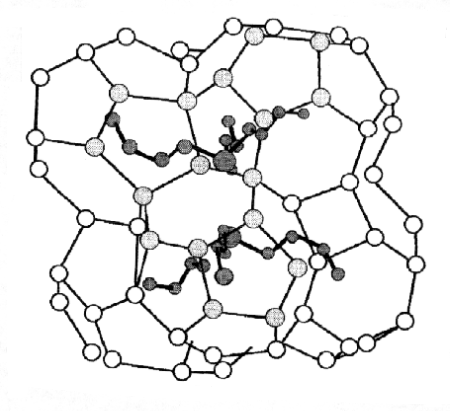
Figura 1.6. Una de las proposiciones sobre la organización de las moléculas de agua alrededor de una molécula apolar.
Una consecuencia de esta organización de la estructura del agua es que la entropía de la solución es menor que la de los dos componentes inicialmente separados, así la hidratación de una sustancia apolar produce una disminución en la entropía. Es decir que la hidratación de substancias apolares en agua va contra uno de los principios básicos de la termodinámica que nos dice que para que un proceso ocurra, la entropía del sistema y sus alrededores debe aumentar. Esta es la razón termodinámica de la dificultad de disolver sustancias hidrofóbicas o no polares en agua.
1.6. El agua y las moléculas biológicas
¿Cual es el efecto del agua sobre las macromoléculas biológicas? ¿Cual será el efecto de las macromoléculas biológicas sobre la estructura del agua?
Las respuestas de estas preguntas son difíciles de separar, ya que ambas son el resultado de las interacciones de las moléculas que la componen. Sabemos que las macromoléculas biológicas contienen tanto grupos polares como apolares, cargados y neutros. En particular, las cadenas laterales de los aminoácidos que componen las proteínas, los nucleótidos en los ácidos nucleicos o los azúcares en los polisacáridos, pueden ser hidrofóbicos e hidrofílicos. Por ejemplo si un ámino ácido cargado está ubicado en la superficie de una molécula de proteína, se hidratará de la misma forma descrita para los iones K+, Ca++, etc. Del mismo modo, una región hidrofóbica que queda expuesta al agua, se espera que cree un agujero local en la masa de agua, organizando las moléculas de agua para formar una caja de acuerdo a lo descrito para cualquier compuesto apolar y por lo tanto, este proceso tiende a ser desfavorable. Podemos decir que una Macromolécula puede estar afectando la estructura del agua de varias maneras simultáneamente y que esta organización de las moléculas de agua condiciona la estructura que la macromolécula tenderá a adoptar en solución.
Ideas Importantes
- La molécula de agua es tetrahédrica, dos de las posiciones están ocupadas por átomos de H y las otras dos por los pares de electrones del oxígeno.
- Sus propiedades como solvente provienen de la formación de uniones puente hidrógeno entre las moléculas de agua y las moléculas de soluto.
- La hidratación de moléculas polares es termodinámicamente favorable. La hidratación de sustancias apolares no lo es.
Cuestionario
1. Qué características estructurales hacen que el agua sea un buen solvente de los sistemas biológicos
2. Discuta la siguiente afirmación: Al agregar una sal como MgSO4 a un volumen definido de agua, la energía necesaria para elevar la temperatura de esta solución, es menor que la necesaria para elevar el mismo volumen de agua pura.
3. Discuta el siguiente hecho experimental :Si agregamos un volumen de NaCl a un volumen de agua, el volumen de la solución será menor que la suma de los volúmenes de los componentes antes de la mezcla.
4. Explique la disolución de KCl en agua.¿Qué ocurre con la sal, qué ocurre con el agua?
5. Explique la disolución de CCl4 en agua.
6. ¿Cómo podría explicar la disolución de un polielectrolito en agua?
Bibliografía General
- Grigera, J. Raúl. "Introducción a la Biofísica del Agua" (1976) Editorial Universitaria de Buenos Aires, Argentina.
- S.M.Sienko y R.A.Plane "Química-física Inorgánica" (1963) Editorial Reverté, Buenos Aires.
Bibliografía específica
- Tanford, Charles. in "The hydrophobic effect" (1986) Wiley Interscience. 2nd Edition.
- Cantor, Charles R., and Schimmel, Paul, R. in "Biophysical Chemistry". Part 1, Pag. 279 -283 (1979).
- Liu, K., Brown, M.G., Carter, C. et al (1996) Nature 381: 501-503.