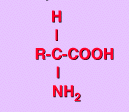
| PROTEINAS, PEPTIDOS Y AMINOACIDOS. |
INTRODUCCION.
Las proteínas son: elementos nitrogenados, formadores y restauradores, de origen animal y vegetal. Estas y otras definiciones se pueden encontrar en diccionarios de lenguaje donde tratan de explicar en forma sencilla y resumida lo que son las proteínas, en cambio en las revistas científicas y libros especializados publican documentos que complican a la mayoría de las personas. Es la inquietud que aflora cuando estas publicaciones no entregan una información clara y precisa de estos grupos de aminoácidos específicos, es por eso que se invita ha introducirse a un trabajo que con sencillez trata de fusionar dos ciencias como son la biología y la química, para dar un respuesta clara y precisa de la primera pregunta que se nos viene a la mente cuando nombran la palabra proteína.....¿Qué son las proteínas?.
OBJETIVOS.
Uno de los objetivos dar respuesta a la interrogante que nosotros mismos los planteamos al no
tener claro lo que son y lo que significan las proteínas, para el ser vivo.
Es estimular a personas que se encuentran ajenos al mundo científico, con definiciones
sencillas de una estructura que a la poca imaginación es de gran dificultad explicarse,
es por eso que la redacción los trata de insertarlos al gran mundo de la bioquímica.
Proteínas.
Son las biomoléculas más abundantes. Constituyen más del 50% de las células, base estructural
de todos los seres vivos.
Están constituidas por aminoácidos unidos entre sí mediante enlaces peptídicos ordenados en
una secuencia perfectamente definida, cuyo peso molecular oscila entre 10.000 y valores que
sobrepasan claramente el millón.
Las proteínas están formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno.
Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y
cobre entre otros elementos. La composición elemental de la mayorías de las proteínas es muy
parecida, los porcentajes aproximados son C = 50% a 55%, H = 6% a 8%, O = 20% a 23%,
N = 15% a 18%, S = 0% a 4%.
Los aminoácidos.
Los aminoácidos son las unidades elementales constituidas de las moléculas, denominadas Proteínas. Son muy elementales, los "ladrillos" con los cuales el organismo reconstituye permanentemente sus proteínas específicas consumidas por la sola acción de vivir, atendiendo a la forma como se orienta el grupo amino de los aminoácidos.
Estereoquímica de los aminoácidos.
Es aquella parte de la química que se preocupa de estudiar la forma de cómo se dispone en el
espacio los grupos químicos que tengan un determinado compuesto.
Los aminoácidos son ácidos carboxílicos en que uno de sus hidrógenos ha sido reemplazado
por un grupo amino y su fórmula general es:
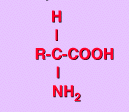
1.- Aminoácidos con grupo R no polares o hidrofóbicos.
Este grupo contiene aminoácidos con residuos alifáticos; alanina, valina, isoleucina y metionina. También aminoácidos con residuos aromáticos; fenilamina y triptófano que son hidrofóbicos. Además, en este grupo están las prolinas cuyo átomo de nitrógeno aparece en forma de amina secundaria en vez de amina primaria usual.
2.- Aminoácido con grupo R polares pero sin carga eléctrica.
La mayoría de estos aminoácidos contienen R polares. Algunos de ellos poseen un grupo hidroxilico; serina, treonina y tiroxina o bien grupos sulfhídricos; cisteina. Se incluye en este grupo a la glicina, ya que, aun cuando carece del grupo R, presenta una naturaleza polar, esto se debe a que los grupos amino y carboxílico cargados constituyen una gran parte de la masa de la molécula. También se incluye en esta división a los compuestos aromáticos como; tirosina.
3.- Aminoácidos con grupo R cargados positivamente.
Aquí se incluyen tres aminoácidos; lisina, arginina e histidina.
4.- Aminoácidos con grupo R cargados negativamente.
En esta división se incluyen a los dos aminoácidos dicarboxilicos; ácido aspartico y
ácido glutámico.
Los aminoácidos pueden condensarse entre sí, uniéndose por el carbono de su grupo carboxilo
al nitrógeno del grupo amino de otro aminoácido, lo que se denomina enlace peptídico.
También se clasifican de acuerda a la cantidad de grupos carboxi y amino en:
neutros: 1 grupo -COOH + 1 grupo -NH2
ácidos: más de 1 grupo -COOH
básicos: más de un grupo NH2
Cuarto grupo con estructura cíclica sin grupo amino.
Comportamiento químico.
En disolución acuosa, los aminoácidos muestran un comportamiento anfótero, es decir pueden ionizarse, dependiendo del pH, como un ácido liberando protones y quedando (-COO-), o como base, los grupos -NH2 captan protones, quedando como (-NH3+ ), o pueden aparecer como ácido y base a la vez.
Enlaces peptídicos.
Están en un nivel intermedio entre aminoácidos y proteínas. Los aminoácidos tienen como
característica lo de formar enlaces entre ellos, esto permite que puedan ir formando
cadenas para que se pueda formar un enlace en un par de aminoácidos, debe producirse una
interacción de tipo covalente, entre el carbono del carboxilo de un aminoácido con el
nitrógeno del grupo amino de otro aminoácido, de esta manera se genera el enlace peptídico o
unión peptídico.

Estructura de las proteínas.
La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
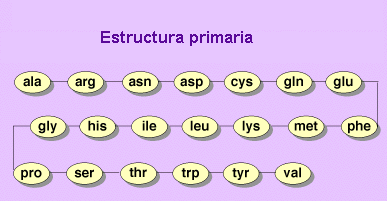
Estructura primaria.
La estructura primaria es la secuencia de aminoácidos de la proteína.
Y nos indica qué los aminoácido componen la cadena polipeptídica y el orden en que
dichos aminoácidos se encuentran. La función de una proteína depende de su secuencia y
de la forma que ésta adopte.
Estructura secundaria.
En la primaria la cadena de aminoácido puede ir rotando respecto de los enlaces que existen.
Como resultado de estas rotaciones la cadena de aminoácidos se va a orientar una determinado
forma en el espacio. La orientación especial en la cadena de aminoácidos es la que se denomina
estructura secundaria.
Van existir distintos tipos de rotación que permiten que haya orientaciones.
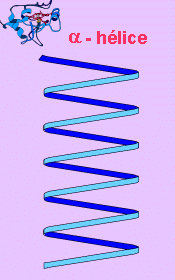
Orientación helicoidal: Se produce un tipo de estructura secundaria que se conoce con el nombre de a(alfa)-helice.
Aquellos que no tienen regularidad de un alfa o un beta, se la conoce como orientación al
azar y a la estructura se le denomina estructura al azar o Randon coil.
Cuando decimos estructura secundaria alfa-hélice es: La cadena de aminoácidos que
tiene una disposición en espiral (en el espacio) que se va enrollando hacia la derecha
(dietratoria o diestra).
En estructura de alfa-hélice además de existir enlaces peptídico ocurre que
estos enlaces peptídico a su vez pueden interactuar entre ellos, mediante un enlace que se
conoce con el nombre de enlace puente hidrógeno, y este se produce en el N-H de una unión
peptídico y él oxigeno del grupo C=O del cuarto que continua en la cadena.
Las proteínas en que encontramos enlaces alfa-hélice son un grupo numeroso, son
proteínas estructurales, las encontramos en el pelo, las uñas, las aves y las plumas.
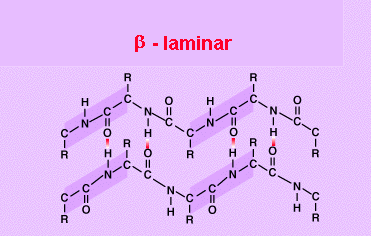
Estructuras beta o laminadas plegadas: como resultado de los giros la cadena no es
helicoidal, la cadena es plegada, y se dispone en el espacio en forma de zig-zag.
Una proteína molecular tiene varia cadenas, y cada cadena tiene una orientación
plegada, las cadenas interaccionan entre ellas con los puentes de H.
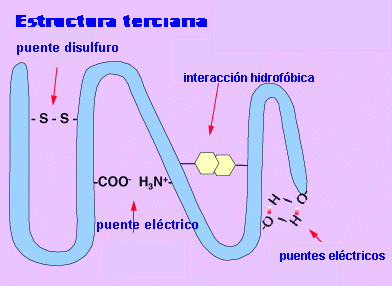
Estructura terciaria.
La estructura terciaria informa sobre la disposición de la estructura secundaria de un
polipéptido al plegarse sobre sí misma originando una conformación globular.
En definitiva, es la estructura primaria la que determina cuál será la secundaria y por
tanto la terciaria.
N N O | | | H H H | | | O N OLos puentes eléctricos: (R+ R-)
Estructura cuaternaria.
Esta estructura informa de la unión, mediante enlaces débiles ( no covalentes) de varias
cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico.
Cada una de estas cadenas polipeptídicas recibe el nombre de protómero o monómero.

Clasificación funcional de las proteínas.
Enzimas: se trata de biocatalizadores. Su estructura
es compleja y tienen un alto grado de especialización. Son la piedra angular
de cualquier proceso metabólico. Se conocen por millares. Como ejemplos podemos
citar la alcoholdeshidrogenasa, la tripsina, o la RNA-polimerasa.
Proteínas de defensa: principalmente las inmunoglobulinas o anticuerpos.
Proteínas de transporte: se encargan de fijarse a nutrientes y
otras sustancias para llevarlas hasta las células o bien atravesar las membranas
celulares. Ej. hemoglobina, mioglobina, lipoproteínas.
Proteínas nutritivas: Ej. la caseína de la leche o la ovoalbúmina
de la clara del huevo.
Proteínas estructurales: Ej. el colágeno (tendones y cartílagos),
la queratina (pelo, uñas, plumas y epidermis).
Proteínas contráctiles: Ej. actina y miosina de los músculos.
Proteínas reguladoras: principalmente hormononas proteicas como
la insulina y la hormona del crecimiento. Según su estructura las podemos dividir
en dos grupos básicos:
Proteínas globulares: adoptan formas esféricas o de ovillo. Suelen
ser solubles en agua y móviles. Ej. las enzimas y las proteínas de transporte.
Proteínas fibrosas: suelen estar enrolladas longitudinalmente
y son insolubles en agua. Ej. proteínas estructurales y musculares.
Propiedades de proteínas.
Especificidad.
La especificidad se refiere a su función; cada una lleva a cabo una determinada
función y lo realiza porque posee una determinada estructura primaria y una
conformación espacial propia; por lo que un cambio en la estructura de la proteína
puede significar una pérdida de la función.
Además, no todas las proteínas son iguales en todos los organismos, cada individuo
posee proteínas específicas suyas que se ponen de manifiesto en los procesos
de rechazo de órganos transplantados. La semejanza entre proteínas son un grado
de parentesco entre individuos, por lo que sirve para la construcción de "árboles
filogenéticos"
Desnaturalización.
Consiste en la pérdida de la estructura terciaria, por romperse los puentes
que forman dicha estructura. Todas las proteínas desnaturalizadas tienen la
misma conformación, muy abierta y con una interacción máxima con el disolvente,
por lo que una proteína soluble en agua cuando se desnaturaliza se hace insoluble
en agua y precipita.
La desnaturalización se puede producir por cambios de temperatura, ( huevo cocido
o frito ), variaciones del pH.
Utilización industrial.
En la industria alimentaría la utilización de enzimas pretende conseguir la
disminución de los costos de la producción con una concentración saturada de
las enzimas con una velocidad máxima alcanzada a corto plazo.
En agroindustria las enzimas una de las tantas proteínas se encarga de controlar
las reacciones asociadas a la maduración de frutas y hortalizas. Después de
que estas han sido cosechadas, las enzimas en algunos de estos alimentos siguen
actuando, es así como permiten la maduración después de que estos han sido extraídos
del medio natural
El consumo de las frutas no solo se realiza en forma directa, puede ser la fruta
consumida al deshidratarse, es ahí donde reaccionan las enzimas y nos permiten
encontrar sabores, olores y texturas nuevas.
Estos son algunos de los usos de las proteínas en la industria, siendo una pequeña
cantidad de las infinidades de usos que se le puede dar a esta estructura.
Propiedades industriales de las proteínas;
Hidratación.
Solubilidad.
Viscosidad.
Gelificación.
Fijación de aromas.
Formación de plantas proteicas.
Emulsificante.
Espumante.
Conclusión.
A pesar de que el mundo gira a una velocidad impresionante y
no permite detenerse en las cosas simples de la vida, hoy hay personas que si
se detienen a observar los detalles fundamentales, son aquellos que estudian
la ciencia y que permiten llevar una vida en que podemos conocer mas a fondo
el funcionamiento molecular de los seres vivos. Es así como en este trabajo
viajamos al mundo molecular de los aminoácidos que al unirse por enlaces forman
las proteínas.
Al analizar lo redactado el lector se puede dar cuenta de lo fundamental de
éstas, y lo cerca que se encuentran de nosotros sin saber que ahí están.
Bibliografía.
Titulo: Fisiología Medica
Autor :William F. Gamos .
Editorial: El Manual Moderno.(México).
Publicado: 1988
Paginas consultadas: 323, 324,332,333.
Titulo: Experimentos De Química
Autor :Xorge A. Dominguez
Editorial: Limusa Wiley S.A..(México).
Publicado: 1968
Paginas consultadas: 63,64,65,67,68,71,72.
Titulo: Las Proteinas En La Nutrición Y En La Industria
Autor :Enrique Yánez , Alfonso Valenzuela, Digna Ballester, Patricio Oliva,
Saturnino de Pablo.
Editores: Enrique Yánez Alfonso Valenzuela .
Publicado: 1983
Paginas consultadas: 5,6,7,84