
| CARBONO Y ESTRUCTURAS. |
INTRODUCCIÓN.
Los
compuestos orgánicos se encuentran formados en su mayoría por cuatro elementos:
C, H, O y N, pero entre ellos el elemento que se destaca sin duda es
el CARBONO.
La gran
cantidad de compuestos de carbono es debido a la capacidad de formar fuertes
enlaces entre átomos de carbono, ya sea en cadenas abiertas o cerradas, o mediante
enlaces simples, dobles o triples. Encontramos entre estos compuestos a aquellos
derivados del petróleo. También se encuentran formados por carbono: los hidratos
de carbono, lípidos, proteínas, ácidos nucléicos.
El carbono es único en la química porque forma un número
de compuestos mayor que la suma total de todos los otros elementos combinados.
El grupo más grande de estos compuestos es el constituido por
carbono e hidrógeno. Se estima que se conoce un mínimo de 1.000.000 de compuestos
orgánicos y este número crece rápidamente cada año. Aunque la clasificación
no es rigurosa, el carbono forma otra serie de compuestos considerados como
inorgánicos, en un número mucho menor al de los orgánicos. Otras formas con poca
cristalinidad son carbón vegetal, coque y negro de humo. El carbono químicamente
puro se prepara por descomposición térmica del azúcar (sacarosa) en ausencia
de aire. Las propiedades físicas y químicas del carbono dependen de la estructura
cristalina del elemento.El carbono libre se encuentra en grandes depósitos como
hulla, forma amorfa del elemento con otros compuestos complejos de carbono-hidrógeno-nitrógeno.

EL CARBONO.
El rol del carbono en la estructura orgánica es proporcional el esqueleto de la molécula, éste determina el tamaño y la forma de la molécula en el tridimensional. También es capaz de formar una amplia variedad de compuestos diferentes y las diferentes formas en que se puede enlazar consigo mismo, como con otros elementos (H, O y N).
Ø Los enlaces simples entre átomos idénticos C—C y H—H son relativamente débiles.
Ø Los enlaces C—H son en promedio más fuertes.
Los enlaces simples C—C y C—H muestran baja tendencia a participar en reacciones químicas, en cambio C—O y C—N que son enlaces más fuertes sufren una variedad de reacciones químicas, esto ocurre por la presencia de pares de electrones no compartidos sobre los átomos de N y O lo que hace que estos átomos sean más susceptibles de ser atacados por átomos deficientes de electrones.Características
del carbono:
|
NOMBRE |
CARBONO |
|
Símbolo |
C |
|
Variedades alotrópicas |
Grafito, diamante |
|
Período |
2 |
|
Grupo |
14 |
|
Masa atómica |
12,0107 |
|
Número atómico |
6 |
|
Número de oxidación |
- 2 ; 2 ; 4 |
|
Estado de agregación |
Sólido |
|
Estructura electrónica |
2 – 4 |
|
Electronegatividad |
2,5 |
|
Energía 1º ionización (medida en eV): |
11,260 |
|
Isótopos (abundancia %) |
12 98,892 |
|
13 1,108 |
Enlaces que forma el carbono:
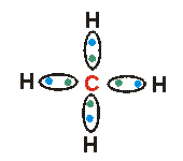
Cada electrón del último nivel se une con un electrón del último
nivel de otro átomo. En el segundo dibujo cada una de estas uniones o enlaces
está representada por líneas. Cada átomo de carbono al unirse necesita completar
4 enlaces.
 |
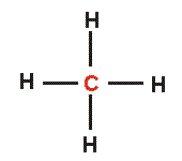 |
| Estructura de lewis de metano. | Fórmula desarrollada del metano. |
La serie de compuestos más sencillos que forma el carbono, se
denomina alcanos,
pertenece a una familia de compuestos llamados hidrocarburos de cadena lineal,
ya que se encuentran formados principalmente por carbono e hidrógeno.

El carbono
está presente en la atmósfera en un 0.03% por volumen como dióxido de carbono.
Varios minerales, como caliza, dolomita, yeso y mármol, tienen carbonatos. Todas
las plantas y animales vivos están formados de compuestos orgánicos complejos
en donde el carbono está combinado con hidrógeno, oxígeno, nitrógeno y otros
elementos. Los vestigios de plantas y animales vivos forman depósitos: de petróleo,
asfalto y betún. Los depósitos de gas natural contienen compuestos formados
por carbono e hidrógeno.
El elemento libre tiene muchos usos, que incluyen desde las aplicaciones
ornamentales del diamante en joyería hasta el pigmento de negro de humo en llantas
de automóvil y tintas de imprenta. Otra forma del carbono, el grafito, se utiliza
para crisoles de alta temperatura, electrodos de celda seca y de arco de luz,
como puntillas de lápiz y como lubricante. El carbón vegetal, una forma amorfa
del carbono, se utiliza como absorbente de gases y agente decolorante.
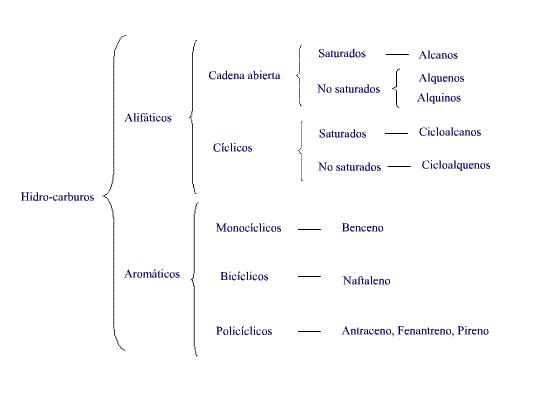
Estructuras del carbono.
Los compuestos orgánicos que contienen solo carbón e hidrogeno reciben el nombre de hidrocarburos. Se les puede dividir en dos clases principales: hidrocarburos alifáticos y aromáticos. Estas dos clases principales se puede dividir en familias, cada una de las cuales presenta propiedades características:
Fórmula general: CnH2n+2
El conjunto de reglas en uso fue desarrollado a través de varias conferencias internacionales que se conocen como las reglas de la unión internacional de química pura y aplicada. (Reglas IUPAC)Los alcanos se clasifican en:
Ejemplos:
CH3 - CH2 - CH2 - CH2 - CH3 ( Pentano) Alcano de cadena continua.
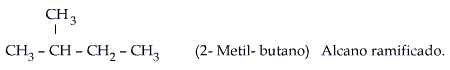
- Los 4 primeros miembros de la serie de hidrocarburos de cadena continua no tienen nombres sistemáticos sino nombres comunes que han sido aceptados por la IUPAC.
Metano CH4
Etano CH3 - CH3
Propano CH3 - CH2 - CH3
Butano CH3 - CH2 - CH2
- CH3
Llos miembros superiores comenzando por el Pentano tienen nombres sistemáticos y estos nombres están compuestos de :
Entre ellos tenemos:
N: indica una cadena no ramificada (Normal)
ISO: Indica la presencia de un grupo (CH3)2
- CH - en el extremo de la cadena continua mas larga del hidrocarburo
NEO: Indica la presencia de un grupo (CH3)3
- C - CH2 - en el extremo de la cadena continua mas larga del
hidrocarburo.
CICLO: se usa para hidrocarburos cíclicos.
Radicales ( R), se forman al remover un átomo de hidrogeno de un hidrogenuro alifático y se nombran reemplazando la terminación ano por ilo.
Ejemplos:
| CH3 - | CH3 - CH2 - CH2 - |
| Metilo | n - propilo |
Los radicales se clasifican en:
Ejemplo:

REGLAS DE LA IUPAC.
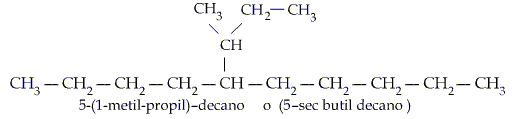
ALQUENOS.
Según la nomenclatura IUPAC.
ALQUINOS.
CICLOALCANOS.
Los ciclo alcanos tienen un anillo y responden a la formula general: CnH2n.
Según la nomenclatura IUPAC:
CICLOALQUENOS.
Según la nomenclatura IUPAC:
Ejemplo:
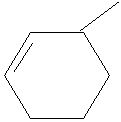 |
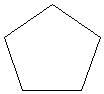 |
|
Metil - ciclohexeno
|
Ciclo pentano
|
<
Los hidrocarburos aromáticos son el benceno y aquellos compuestos aromáticos que se parecen al benceno en su conducta quimica .
CONCLUSION.
Bibliografía.
 |
 |
