
| ALDEHÍDOS Y CETONAS. |
INTRODUCCION.
La Química Orgánica es aquella
parte de la Química que estudia principalmente los compuestos que contienen
Carbono, sin embargo no todos los compuestos que contienen carbono son Orgánicos,
como por ejemplo los carbonatos, los carburos metálicos, el monóxido y el dióxido
de Carbono. El conocimiento y la utilización de los compuestos Orgánicos se
confunden con el origen mismo del ser humano, los colorantes de Origen Natural,
extractos de plantas y animales podían causar la muerte o aliviar enfermedades,
eran utilizados desde tiempos remotos.
Existen agrupaciones de átomos que les confieren a los compuestos orgánicos
sus características químicas, o capacidad de reaccionar con otras sustancias
específicas. Son los llamados Grupos Funcionales. La mayor parte de las sustancias
Orgánicas solo se componen de Carbono, Oxígeno e Hidrógeno, pero la forma en
que están enlazado estos elementos pueden dar origen a distintos compuestos,
que pertenecerán a distintos Grupos funcionales.
En nuestro informe analizaremos un Grupo Funcional: Aldehídos y Cetonas, dando
sus principales características, normas de Nomenclatura, principales reacciones,
y la aplicación en la Industria.
DEFINICION DE ALDEHIDOS Y CETONAS.
El grupo funcional conocido como
grupo carbonilo, un átomo de carbono unido a un átomo de oxigeno por un doble
enlace- se encuentra en compuestos llamados aldehídos y cetonas.
En los aldehídos.el grupo carbonilo se une a un átomo de hidrógeno y a un radical
Alquilo, con excepción del formaldehído o metanal.
En los aldehídos.el grupo carbonilo se une a un átomo de hidrógeno y a un radical
Alquilo, con excepción del formaldehído o metanal.


NOMENCLATURA DE ALDEHIDOS Y CETONAS.
Para denominar los aldehídos y
cetonas se puede usar el sistema IUPAC. En ambos casos primero se debe encontrar
la cadena hidrocarbonada más larga que contenga al grupo carbonilo. La terminación
-o de los hidrocarburos se reemplaza por -al para indicar un aldehído.
Las cetonas se denominan cambiando la terminación -o de la cadena carbonada
lineal más larga que contienen al grupo carbonilo por la terminación -ona del
carbonilo en la cadena carbonada.
Algunos aldehídos y cetonas comunes.
|
Fórmula
condensada
|
Nombre
según IUPAC
|
Nombre común
|
|
Aldehído
|
|
|
|
HCHO
|
Metanal
|
Formaldehído
|
|
CH3CHO
|
Etanal
|
Acetaldehído
|
|
CH3CH2CHO
|
Propanal
|
Propionaldehído
|
|
CH3CH2CH2CHO
|
Butanal
|
Butiraldehído
|
|
C6H5CHO
|
Benzaldehído
|
Benzaldehído
|
|
|
|
|
|
Cetonas
|
|
|
|
CH3COCH3
|
Propanona
|
Cetona
(dimetilcetona)
|
|
CH3COC2CH5
|
Butanona
|
Metiletilcetona
|
|
C6H5COC6H5
|
Difenilmetanona/cetona
|
Benzofenona
|
|
C6H10O
|
Clicohexanona
|
Ciclohexanona
|
REACCIONES.
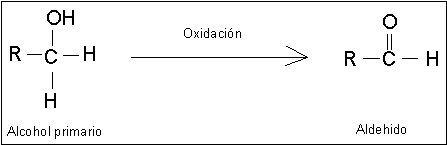
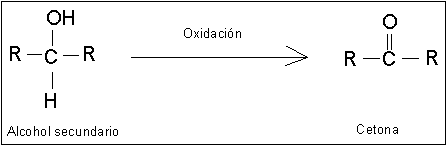
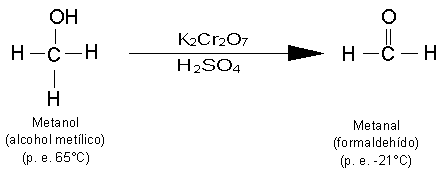
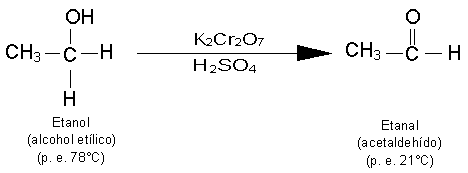
Reacciones de Oxidación de Alcoholes.
Los alcoholes primarios pueden oxidarse a aldehídos y los alcoholes secundarios,
a cetonas. Estas oxidaciones se presentan en la forma siguiente:
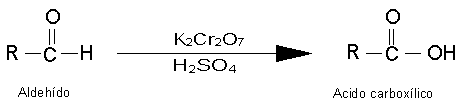
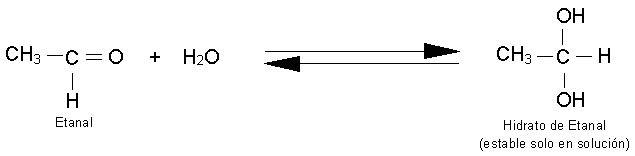
Reacciones de adición al grupo
carbonilo.
Las reacciones más características para
aldehídos y cetonas son las reacciones de adición. Al doble enlace carbono -
oxígeno del grupo carbonilo se añade una gran variedad de compuestos.

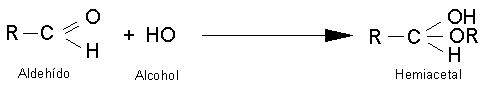
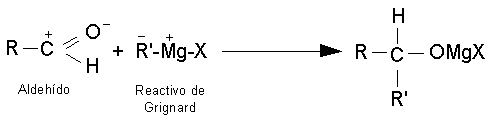
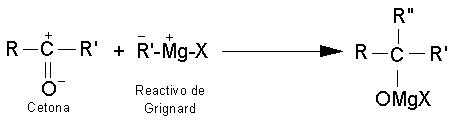
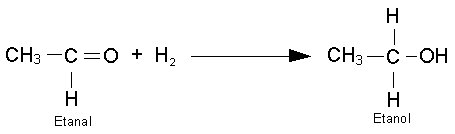
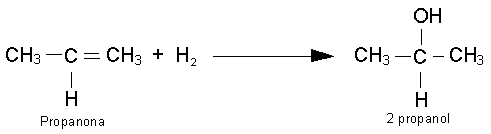
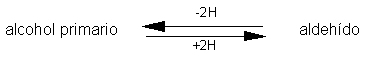
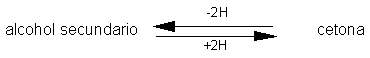
METODOS DE OBTENCIÓN.
Hidratación de alquinos.
En presencia de sulfato mercúrico y ácido sulfúrico
diluido, como catalizadores, se adiciona una molécula de agua al triple enlace
de un alquino, con lo que se forma primero un enol que, al ser inestable, se
isomeriza por reagrupamiento en un compuesto carbonílico. Únicamente cuando
se utiliza acetileno como producto de partida se obtiene acetaldehído, según
la reacción:
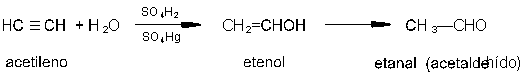
Reacción de Friedel y Crafts.
Se emplea para la obtención de aldehídos y cetonas
aromáticas. Consiste en hacer reaccionar un cloruro de ácido o un anhídrido
con un compuesto aromático apropiado.
Para obtener una cetona se procederá así:
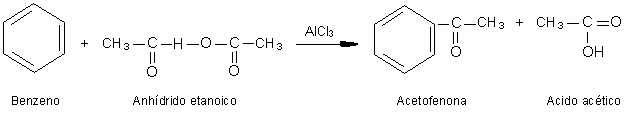
Ozonización de alquenos.
La ozonización de alquenos da lugar a aldehídos o
cetonas, según que el carbono olefínico tenga uno o dos sustituyentes hidrocarbonados.
Esta reacción no suele utilizarse con fines preparativos, sino más bien en la
determinación de estructuras para localizar la posición de los dobles enlaces.
DETECCIÓN DE ALDEHÍDOS.
Los aldehídos y las cetonas reaccionan con una gran variedad de compuestos, pero en general los primeros son más reactivos que las cetonas. Los químicos han aprovechado la facilidad con que un aldehído puede oxidarse para desarrollar varias pruebas visuales para su identificación. Las pruebas de detección de aldehídos mas usadas son las de Tollens, Benedict y Fehling.
La prueba de Tollens.
El reactivo de Tollens, el agente de oxidación suave
usado en esta prueba, es una solución alcalina de nitrato de plata, es transparente
e incolora. Para evitar la precipitación de iones de plata como oxido de plata
a un pH alto, se agregan unas gotas de una solución de amoniaco, que forma con
los iones plata un complejo soluble en agua:

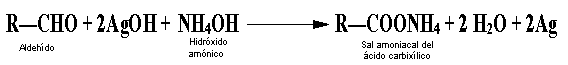
Prueba de Benedict y Fehling.
Los reactivos de Benedict y Fehling son soluciones
alcalinas de sulfato de cobre de un color azul intenso, de composición ligeramente
distintas. Cuando se oxida un aldehído con el reactivo de Benedict y Fehling,
se obtiene u precipitado rojo brillante de óxido cuproso (Cu2O). La reacción
con acetaldehído es:
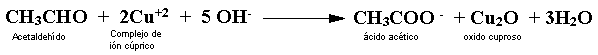
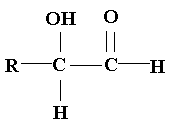
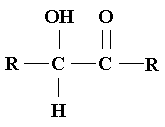
Alfa-hidroxicetonas.
Usualmente, las cetonas no se oxidan por acción de oxidantes
débiles como las soluciones de Benedict o de Fehling. Sin embargo, las cetonas
que contienen un grupo carbonilo unido a un carbono que soporta un grupo hidroxilo
dan pruebas positivas con los reactivos de Tollens, Benedict y Fehling. Estos
compuestos se llaman alfa-hidroxialdehídos y alfa-hidroxicetonas,
y sus estructuras generales son:
|
alfa-hidroxialdehídos
|
alfa-hidroxicetonas
|
 |
 |
CARACTERISTICAS DE ALDEHIDOS Y CETONAS.
El grupo carbonilo, característico del aldehído y cetonas, confiere
a éstos compuestos de reactividad especial. Como el átomo de oxigeno es mucho
más electronegativo, atrae mas a los electrones que el átomo de carbono.
El carbono del grupo carbonilo presenta hibridación sp2 por lo que los 3 átomos
que están unidos directamente a él se encuentran en un mismo plano de aproximadamente120°.
Los aldehídos y cetonas se caracterizan por presentar reacciones comunes que
se deben a la estructura del carbonilo. Sin embargo, la distinta ubicación del
grupo carbonilo en la cadena hidrocarbonada ( en el extremo para los aldehídos)
supone ciertas diferencias entre las dos funciones.
Los aldehídos y cetonas en el infrarrojo presentan una banda de absorción entre
1.670 y 1.730 cm-1, debido a la vibración de tensión del enlace carbono - oxigeno.
En el ultravioleta hay también una absorción débil entre los 2600 y 3000 A.
En la espectroscopia RMN se puede distinguir la función aldehído de la función
cetona por su diferente desplazamiento químico en el espectro.
Tanto aldehído como la cetona presentan una reacción características con la
2,4-dinitrofenilhidracina para dar las correspondientes hidrazonas que constituyen
un precipitado rojo- naranja, lo cual permite evidenciar su presencia.
Puntos de ebullición.
Los aldehídos y las cetonas no pueden formar enlaces intermoleculares
de hidrógeno, porque al carecer de grupos hidroxilo (-OH) sus puntos de ebullición
son más bajos que los alcoholes correspondientes. Sin embargo, los aldehídos
y las cetonas pueden atraerse entre sí mediante las interacciones polar-polar
de sus grupos carbonilo y sus puntos de ebullición son mas altos que los de
los alcanos correspondientes.
Con excepción del metanal, que es gaseoso a la temperatura ambiente, la mayor
parte de los aldehídos y cetonas son líquidos y los términos superiores son
sólidos. Los primeros términos de la serie de los aldehídos alifáticos tienen
olor fuerte e irritante, pero los demás aldehídos y casi todas las cetonas presentan
olor agradable por lo que se utilizan en perfumería y como agentes aromatizantes.
|
Compuesto
|
Punto
de fusión
[ºC] |
Punto
de ebullición
[ºC] |
Solubilidad
en agua
[g/100ml] |
|
Aldehídos
|
|
|
|
|
Formaldehído
|
-92
|
-21
|
Completamente
miscible
|
|
Acetaldehído
|
-123
|
20
|
Completamente
miscible
|
|
Butiraldehído
|
-99
|
76
|
4
|
|
Bezaldehído
|
-26
|
179
|
0.3
|
|
Cetonas
|
|
|
|
|
Acetona
|
-95
|
56
|
completamente
miscible
|
|
Metiletilcetona
|
-86
|
80
|
25
|
|
Dietilcetona
|
-42
|
101
|
5
|
|
Benzofenona
|
48
|
306
|
Insoluble
|
Solubilidad en agua.
Los aldehídos y las cetonas pueden formar enlaces
de hidrógeno con las moléculas polares del agua. Los primeros miembros de la
serie (formaldehído, acetaldehído y acetona) son solubles en agua en todas las
proporciones. A medida que aumenta la longitud de la cadena del hidrocarburo,
la solubilidad en agua decrece. Cuando la cadena carbonada es superior a cinco
o seis carbonos, la solubilidad de los aldehídos y de las cetonas es muy baja.
Como era de suponer, todos los aldehídos y cetonas son solubles en solventes
no polares.
EFECTOS DE ALDEHIDOS Y CETONAS EN LA SALUD HUMANA.
Cuando se bebe alcohol etílico, este se oxida en el hígado a
acetaldehído, que, a su vez, se oxida a ácido acético y, por ultimo a dióxido
de carbono y agua:

APLICACIONES DE ALDHEIDOS Y CETONAS.
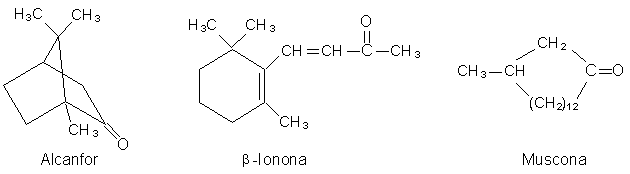
Se ha aislado una gran variedad de aldehídos y cetonas a partir
de plantas y animales; muchos de ellos, en particular los de peso molecular
elevado, tienen olores fragantes o penetrantes. Por lo general, se les conoce
por sus nombres comunes, que indican su fuente de origen o cierta propiedad
característica. A veces los aldehídos aromáticos sirven como agentes saborizantes.
El benzaldehído (también llamado "aceite de almendra amargas")es un componente
de la almendra; es un liquido incoloro con agradable olor a almendra. El cinamaldehído
da el olor característico a la esencia de canela. La vainilla -que produce el
popular sabor a vainilla- durante un tiempo se obtuvo solo a partir de las cápsulas
con formas de vainas de ciertas orquídeas trepadoras. Hoy día, la mayor parte
de la vainilla se produce sintéticamente:
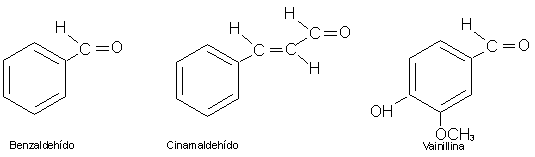
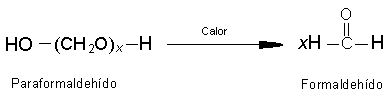
CONCLUSIÓN.
Los aldehídos y las cetonas contienen el grupo carbonilo (C=O). El carbono carbonílico de un aldehído está unido como mínimo a un hidrógeno (R-CHO), pero el carbono carbonílico de una cetona no tiene hidrógeno (R-CO-R). El formaldehído es el aldehído más sencillo (HCHO); la acetona (CH3COCH3) es la cetona más simple. Las propiedades físicas y químicas de los aldehídos y las cetonas están influidas por la gran polaridad del grupo carbonilo. Las moléculas de aldehídos y cetonas se pueden atraer entre sí mediante interacciones polar-polar. Estos compuestos tienen puntos de ebullición más altos que los correspondientes alcanos, pero más bajos que los alcoholes correspondientes. Los aldehídos y las cetonas pueden formar enlaces de hidrógeno, y los de bajo peso molecular son totalmente solubles en agua.
Los aldehídos y cetonas son producidos por la oxidación de alcoholes
primarios y secundarios, respectivamente. Por lo general, los aldehídos son
más reactivos que las cetonas y son buenos agentes reductores. Un aldehído puede
oxidarse al correspondiente ácido carboxílico; en cambio, las cetonas son resistentes
a una oxidación posterior.
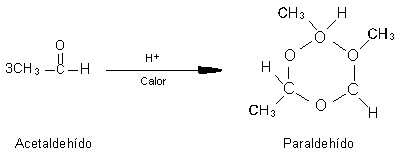
Muchos aldehídos y cetonas tienen aplicaciones importantes. Los compuestos industriales
más importantes son el formaldehído, acetaldehído, llamado formalina, se usa
comúnmente preservar especímenes biológicos. El benzaldehído, el cinamaldehído,
la vainilla, son algunos de los muchos aldehídos y cetonas que tienen olores
fragantes.
BIBLIOGRAFÍA.