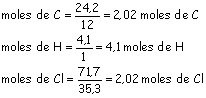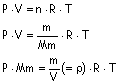| Ejercicio 2 | |
|
Un compuesto orgánico
en fase gaseosa tiene una densidad de 3'3 g/l, medida a 95ºC y 758
mmHg, y su composición centesimal experimental es: C (24,2 %), H (4,1
%) y Cl (71,1 %). Determine su fórmula molecular.
Datos: C = 12 ; Cl = 35,5 ; H = 1 |
|
| Solución | |

Suponiendo una masa de 100 g dividimos los porcentajes de cada elemento entre sus pesos atómicos para saber cuántos moles de átomos hay de cada uno de ellos.
Salta a la vista que la proporción es 1:2:1, aunque si nos hubiese dado esta misma proporción tras haber dividido las cantidades entre 2,02. Luego la fórmula empírica es: (CH2Cl)n
El valor de n se calcula conociendo la masa molecular del compuesto, que calcularemos a partir de la ecuación general de los gases:
sustituyendo:
La masa molecular se calcularía también:
La fórmula molecular será entonces: (CH2Cl)n |
|