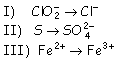| Ejercicio 17 | |
|
a)
Defina el concepto electrónico de oxidación y de reducción.
b) Indique cuál o cuales de las semirreacciones siguientes corresponden a una oxidación y cuál o cuales a una reducción. c) Indique la variación del número de oxidación del cloro, hierro y azufre. |
|
| Solución | |
|
a) Conceptos:
OXIDACIÓN: es un proceso en el que el estado de oxidación de algún elemento aumenta, es decir, hay pérdida de electrones. Estos suelen aparecer en lado derecho de la semirreacción. REDUCCIÓN: es un proceso en el que el estado de oxidación de algún elemento disminuye, es decir, hay ganancia de electrones. Estos suelen aparecer en lado izquierdo de la semirreacción. b) Semirreacciones: Oxidación: [2] y [3] Reducción: [1]
c) El número de oxidación n.o. del cloro en el ion ClO 2- es +3, pasando a –1; su variación es por tanto de –4 (disminuye cuatro unidades).Para la segunda semirreacción, el S pasa de tener n.o. A +6; su variación es +6 (aumenta seis unidades) Por último, en el caso del hierro, aumenta una unidad, de +2 a +3
|
|