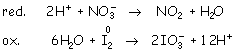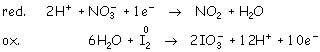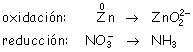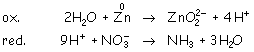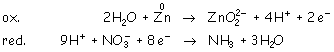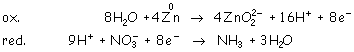| Ejercicio 10 | |||
|
Ajusta las siguientes ecuaciones redox:
|
|||
| Solución | |||
|
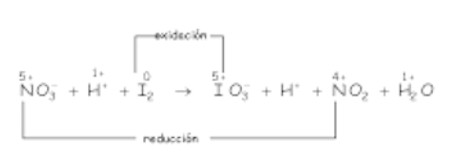
a)
Cambian de número de oxidación el iodo y el nitrógeno, con lo que las ecuaciones REDOX son:
Ajuste atómico:
Ajuste con electrones:
Multiplicando por diez la primera ecuación:
Como tenemos Como tenemos Sumamos por tanto 2H+ a cada miembro de la ecuación obteniendo finalmente:
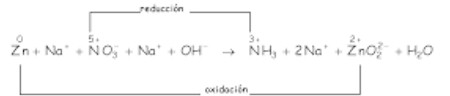
b)
Cambian de número de oxidación el cinc y el nitrógeno, con lo que las ecuaciones REDOX son:
Ajustamos con H2O y H+:
Ajustamos con los electrones que sean necesarios:
Multiplicamos la primera ecuación por cuatro:
Faltan OH- en el primero y sobran H+ en el segundo. Añadimos 16OH- para neutralizar los H+ del mayor para dar OH-. Hacemos esto porque nos encontramos en medio básico.
De esta ecuación deducimos:
Simplificando:
Ecuación ajustada:
|
|||