|
Ejercicio 9
|
|
|
Dada la siguiente tabla de
potenciales normales de reducción expresados en voltios:
|
Par redox
|
e
º
|
|
Cl2 /
Cl-
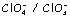
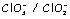
Cu2+ /
Cu0
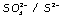
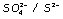
Sn4+ /
Sn2+
Sn2+ /
Sn0
|
1,35
1,19
1,16
0,35
0,23
0,15
0,15
-0,14
|
a) Escriba el nombre de :
- La forma reducida del oxidante más
fuerte.
- Un catión que pueda ser oxidante y
reductor.
- La especie más reductora.
- Un anión que puede ser oxidante y
reductor.
b) Escriba y ajuste dos
reacciones que sean espontáneas entre las especies que figuren en
la tabla que correspondan a cada una de estas reacciones redox:
- Una oxidación de un catión por un anión.
- Una reducción de un catión por un anión.
Escriba la f.e.m. estándar
de cada una de las pilas así formadas.
|
|
|
|
Solución
|
|
a)
- El oxidante más fuerte es el que más se reduce:
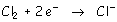
La forma reducida del oxidante más fuerte (Cl2)
es el Cl-.
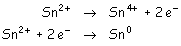
- La especie más reductora es la que más se oxida, será la
del potencial normal de electrodo más bajo.
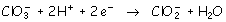
El par 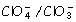 actúa como reductor oxidándose a anión clorato:
actúa como reductor oxidándose a anión clorato:
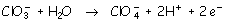
b)
Para que esto sea así se puede elegir entre los
presentes cualquier par aniónico cuya e
0>0,15:
e 0 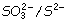 = 0,08 V.
= 0,08 V.
e 0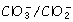
= 1,01 V.
e 0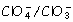 = 1,04 V.
= 1,04 V.
por ejemplo:
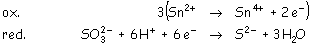
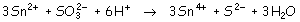
- En el segundo caso nos piden una reducción espontánea de un
catión por un anión.
Por ejemplo:
El potencial de reducción de anión que se oxide
ha de tener un potencial normal menor que el catión que se reduce
(para conseguir f.e.m. pila > O).
p. ej:
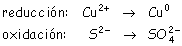
Con lo que el ajuste sería:
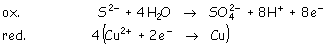
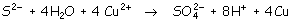
|
|