| Ejercicio 7 | |||
|
Ajusta las siguientes ecuaciones redox:
|
|||
| Solución | |||
|
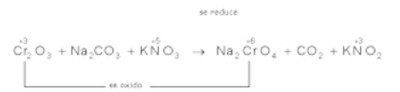
a)
Cambio en el número de oxidación cromo y nitrógeno:
Se trata de una reacción en medio básico
(originado con los iones Ajuste de electrones y ecuación iónica ajustada: ox.
red
Añadiendo tantos OH- como H+ aparezcan en la anterior ecuación, obtenemos:
Posteriormente se obtiene:
Simplificando:
Recordando que en medio básico En el ajuste final despreciamos los moles de H2O, obteniendo:
el coeficiente del CO2 se obtiene a partir del carbonato de sodio.
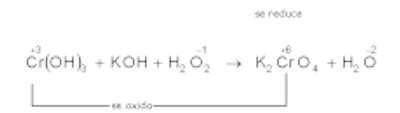
b)
Cambian su número de oxidación el cromo y el oxígeno: oxidación: reducción:
Sumamos electrones:
Ecuación iónica ajustada: ox.
red.
Simplificando;
El ajuste final será:
Los |
|||