| Ejercicio 6 | |
|
Ajusta las siguientes reacciones redox:
NOTA: el KAlO2 es el aluminato potásico formado por el anión AlO2- y el catión K+. |
|
| Solución | |
|
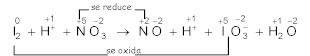
a) Forma iónica de la ecuación e identificación
de los átomos que se oxidan y se reducen:
Las semireacciones de oxidación – reducción ajustadas son: oxidación: I2 + 6H2O "
2I reducción: N Ajuste de electrones y ecuación iónica ajustada: ox.
red.
Se puede eliminar 30e- , 36H+ y 18 H2O que aparezcan en los dos miembros, con lo que queda:
Ecuación molecular ajustada:
se han introducido 6H+ en el primer
miembro para completar los
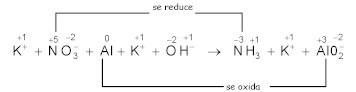
b) Forma iónica de la ecuación e identificación de los átomos que se oxidan y se reducen:
Semirreacciones de oxidación - reducción ajustadas: oxidación: reducción:
Ajuste de electrones y ecuación iónica ajustada: ox.
8 ( red.
3( Se puede eliminar 24e-, 16 H2O y 27 OH- que aparecen en los dos miembros, con lo que queda:
Ecuación molecular ajustada:
Se han introducido 8 K+ en cada miembro. |
|