| Ejercicio 3 | |
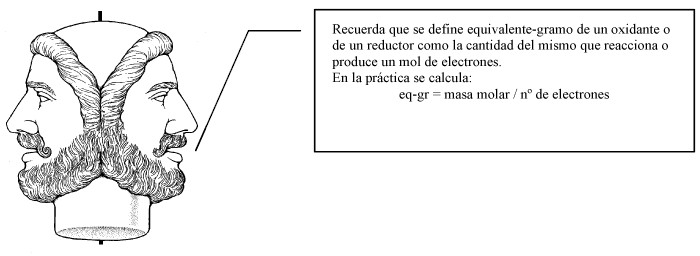
| El clorato potásico oxida al ion cromo (III) a cromato en medio básica reduciéndose a cloruro. Si partimos de sulfato de cromo (II), clorato potásico e hidróxido potásico, se forma cromato potásico y sulfato potásico y agua. Ajustar la reacción iónica y molecular por el método del ion electrón. ¿Por cuánto hay que dividir la masa molecular del clorato potásico para obtener su peso equivalente según esta reacción?. Hállelo. | |
| Solución | |
|
La
reacción que nos piden ajustar es:
KClO3 + Cr2(SO4)3 + KOH ® K2CrO4 + KCl + K2SO4 + H2O Semirreacción de oxidación: Cr3+ + 8 OH- D CrO42- + 4 H2O + 3 e-Semirreacción de reducción: ClO3- + 3 H2O + 6 e- D Cl- + 6 OH- Para igualar cargas multiplicamos la primera reacción (x2) y se suman obteniendo: ClO3- + 2 Cr3+ + 10 OH- ® 2 CrO42- + Cl- + 5 H2O Ahora se transportan los coeficientes a la reacción molecular y se halla el coeficiente del sulfato de potasio por "la cuenta de la vieja".KClO3 + Cr2(SO4)3 + 10 KOH ® 2 K2CrO4 + KCl + 3 K2SO4 + 2 H2O
b)
|
|