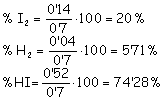| Ejercicio 27 | |||||||||||||||||||||||||||||||||||||||||
|
En
un recipiente de un litro de capacidad se introducen 0’4 moles de
yoduro de hidrógeno, 0’2 moles de yodo y 0’1 moles de hidrógeno.
La KC para la descomposición del yoduro de hidrógeno ajustada a
dos moles descompuestos, vale 2’07.10-2 mol/l a una temperatura de
1000oK.
a) Discuta razonadamente hacia dónde se desplazará la reacción
para alcanzar
el equilibrio.
b) Calcule el porcentaje que hay de cada gas en el equilibrio.
c) Calcule la presión parcial de cada gas en el equilibrio y
la Kp.
d) Si para el mismo equilibrio, inicialmente sólo se hubiesen
introducido 64 g
de yoduro de hidrógeno, ¿qué tanto por ciento quedaría sin
disociar una
vez alcanzado el equilibrio?. ¿Cuánto valdrá el grado de
disociación?
e) Discuta y Justifique la evolución del equilibrio si:
e.1) Se disminuye la temperatura (la descomposición es exotérmica)
e.2) Se añade yodo.
e.3) Se añade al recipiente un gas noble (que no reacciona)
e.4) Se añade un catalizador. (Masas atómicas: I = 127 ; H = 1) |
|||||||||||||||||||||||||||||||||||||||||
| Solución | |||||||||||||||||||||||||||||||||||||||||
|
a)
b)
3’31.10-3
+ 0’083 x2 + 0’0331 x = x2 – 0’3 x +
0’02 0
= 0’917 x2 – 0’3331 x + 0’0167 x1
= 0’3031 (no es válida; no puede reaccionar más de lo que hay) x2
= 0’06
Õ
válida Por lo tanto:
[I2]= 0’2 – 0’06 = 014 moles/litro
[H2] = 0’1 – 0’06 =
0’04 moles /litro
[HI]= 0’4 + 2 . 0’06 = 0’52 c)
Pp I2 = 0’2 . 57’4 = 11’48
atm ; Pp H2
= 0’571 . 57’4 = 32’77 atm ; Pp HI = 0’743 . 57’4 = 42’64 atm d)
a
= (2 - 2a)
. 0’144 = 0’288 – 0’288 a 1’288
a
= 0’288 Õ
Quedará,
por tanto, un 77’7 % e) Según
el principio de LeChatelier que dice que ante una perturbación el
equilibrio siempre reacciona compensando dicha perturbación se
puede decir que:
1) Si se
disminuye la temperatura el equilibrio tenderá a aumentarla desplazándose
en sentido exotérmico, es decir, hacia la derecha.
2) Si se añade
I2, el equilibrio tenderá a consumirlo lo que implica un
desplazamiento hacia la izquierda para alcanzar un nuevo equilibrio.
3) Si se añade
un gas noble no reactivo, el efecto es el mismo que si se aumenta
la presión, pues ésta es indiferente al tipo de sustancia
gaseosa. Por lo tanto el equilibrio se desplazaría en el sentido en
el que se produzca un menor número de moles, sentido que no existe
en el equilibrio que nos ocupa. Por lo tanto el equilibrio no se
desplaza.
4) El
catalizador aumenta la velocidad en los dos sentidos, por lo que el
equilibrio no se ve alterado. |
|||||||||||||||||||||||||||||||||||||||||