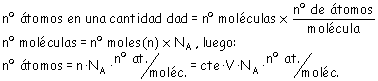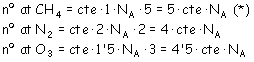Luego el recipiente de N2 será el que tenga el
mayor número de moles y, por tanto de moléculas (recuerde la
relación entre el número de moles y moléculas a través del NA,
número de Avogadro.
b) Ahora hay que tener en cuenta el número de
átomos que contiene cada molécula de las tres sustancias dadas.
Podemos expresar que:
c) La densidad de una sustancia se define como
la relación entre la masa que tiene y el volumen que ocupa (d =
m/V). Se puede expresar la masa como: m = n x Mm, siendo Mm la
masa molar.
Por otro lado: (a), n = cte x V, luego m = cte
x V x Mm, por lo que vemos que en estas condiciones la densidad de
cada recipiente es directamente proporcional a la masa molar del
gas que contenga.
Por lo tanto, el recipiente que contiene O3
(ozono) es el que tiene mayor densidad.