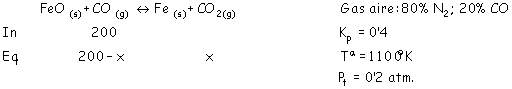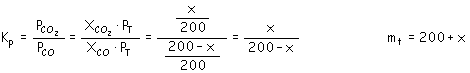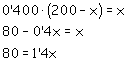| Ejercicio 25 | |
|
Según
el proceso de Ellingham a 1100oC se puede obtener hierro (Fe) en los
altos hornos a partir de la reacción:
FeO(s) A través de 5 toneladas (exceso) de FeO(s) se hace pasar gas aire, 20 % de CO y 80 % de N2, (composición en moles); conociendo que Kp a dicha temperatura vale 0’400, ¿cuántos Kg. De Fe se obtendrán al pasar 1000 moles de mezcla gaseosa? Explique si el aumento de presión y el aumento de temperatura beneficiarán el proceso de obtención de hierro mediante este procedimiento. Masas atómicas: Fe = 55’85 ; C = 12’011 ; O = 16) |
|
| Solución | |
|
Discusión ..Le Châtelier:
|
|