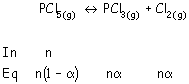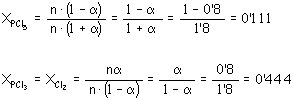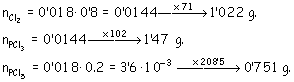| Ejercicio 22 | |
|
A
300oC y a 1’5 atm. de presión, el pentacloruro de fósforo está
disociado en un 80 % según el equilibrio: PCl5 (g) PCl3 (g) + Cl2 a)¿Cuánto valen Kc y Kp a dicha presión y temperatura?
c)¿Cómo influiría en el equilibrio
|
|
| Solución | |
|
Reacción de disociación en el equilibrio será:
a)
b) Para calcular la densidad sólo nos falta la masa total, que calculamos a partir de los moles, por tanto: Cálculo de moles totales:
masa total
c) Para responder a los tres apartados, nos fijamos en el principio de LeChâtelier que dice: Cuando en un sistema en equilibrio se produce una modificación de algunas variables que lo determinan (concentración, T, P), el equilibrio se desplaza en el sentido en que tiende a oponerse o minimizar dicha variación. Por tanto:
|
|