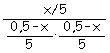| Ejercicio 19 | |||||
|
Para
la reacción en fase gaseosa entre el tricloruro de fósforo y cloro
para dar pentacloruro de fósforo, la constante de equilibrio, Kc,
vale 49 a 230ºC.
Calcular:
|
|||||
| Solución | |||||
|
a) Llamando x a los moles de pentacloruro de fósforo que hay en el equilibrio, obtenemos:
Equilibrio de síntesis:
PCl3 (g) +
Cl2 (g) Moles iniciales: 0,5 0,5 0 Moles en equilibrio: 0,5 – x 0,5 – x x
Kc = Solución posible x = 0,32 mol. Calculamos ahora las fracciones molares: Moles totales: (0,5 – x) + (0,5 – x) + x = 1 – x = 1 – 0,32 = 0,68 moles. Nº moles de cada gas en equilibrio:
b) Puesto que D n = -1
|
|||||