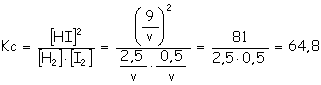| Ejercicio 16 | |
Una
mezcla gaseosa constituída inicialmente por 7 moles de hidrógeno y
5 moles de iodo en estado gaseoso se calienta a 400ºC, con lo que
se forman 9 moles de HI. Calcule:
DATOS: D H reacción = - 10,5 KJ. |
|
| Solución | |
|
H2 (g) +
I2 (g) Inicio 7 5 _
Equilibrio
7 –
a) Como el hidrógeno y el iodo reaccionan mol a mol,
formando dos moles de HI, si se forman 9 moles de HI quiere decir
que habrán desaparecido
b) H2 (g) + I2 (g)
|
|