| Ejercicio 15 | |||
En
un recipiente de 30 litros de capacidad se calienta una mezcla de 1
mol de hidrógeno y 1 mol de iodo hasta 448ºC estableciéndose a
dicha temperatura un equilibrio entre los dos elementos y el ioduro
de hidrógeno formados. Sabiendo que el valor de la constante de
equilibrio es entonces 50, determínese:
|
|||
| Solución | |||
|
a) El equilibrio que tendrá lugar será: I2 (g) + H2 (g) Inicio 1 1 _ Equilibrio 1 – x 1 – x 2x (en el equil. quedarán 1-x moles de I2)
Luego los moles de I2 que nos quedan sin reaccionar serán:
b) I2 (g) +
H2 (g) Inicio 0,22 0,22 + 1 1,56 Equilibrio 0,22 – x 1,22 – x 1,56 + 2x
en donde: x1 = 1,546 (absurdo) x2 = 0,154 Luego los moles de I2 sin reaccionar serán:
|
|||
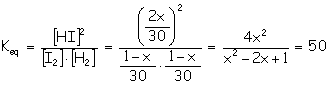 a x1 = 1,39 ; x2
= 0,78
a x1 = 1,39 ; x2
= 0,78
