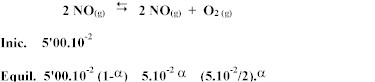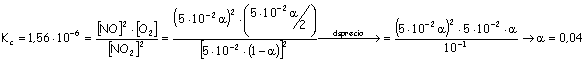| Ejercicio 10 | |
|
Un
recipiente de 1,00 l contiene 5,00.10-2 moles de NO2
y se calienta hasta 327ºC, estableciéndose el
equilibrio siguiente:
La constante (Kc) del mismo a 327ºC vale 1'56.10-6. Calcular: (a) El porcentaje de disociación en esas condiciones; (b) La concentración de los componentes en el equilibrio y (c) La concentración de cada especie en el equilibrio si se añade 1,00 mol de O2. Si aumentásemos la presión, ¿hacia dónde evolucionará el equilibrio?. Explica la respuesta. |
|
| Solución | |
|
Un aumento de presión forzaría el equilibrio (Le Chatelier) a reducirla, desviando el equilibrio a la izquierda en donde hay un menor número de moles. |
|