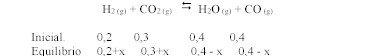|
Ejercicio 9
|
|
La
constante de equilibrio para la reacción:
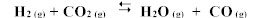
es Kc = 1,6 a 986ºC
Un recipiente de un litro
contiene inicialmente una mezcla de 0,2 moles de H2 ; 0,3
moles de CO2 ; 0,4 moles de agua y 0,4 moles de CO a 986ºC.
- Justificar por qué esta mezcla no está
en equilibrio.
- Si los gases reaccionan hasta alcanzar
el equilibrio, a 986ºC, calcular las
concentraciones finales de la mezcla gaseosa. Justificar el
resultado.
|
|
|
|
Solución
|
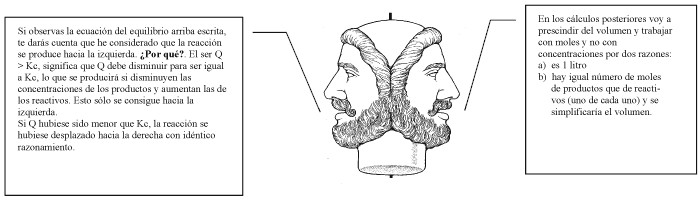
a)
Calculando
la expresión del cociente de concentraciones se podrá discutir
la situación:
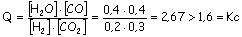
Como Q ¹ Kc, la
mezcla no está en equilibrio.
b)
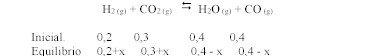
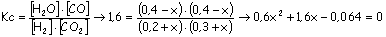
La
solución con sentido es x = 0,039. Por lo tanto en el equilibrio:
[H
2] = 0,239 mol/L ; [CO 2] = 0,339 mol/L ; [CO] =
[H2O] = 0,361 mol/L
c)
Pinicial
= Pfinal
Moles totales = 0,239 + 0,339 + 0,361 + 0,361 =
1,3 mol
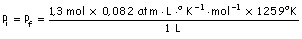 =
134 atm =
134 atm

|
|