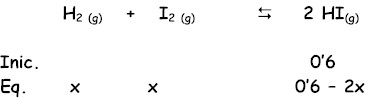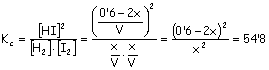| Ejercicio 5 | |
|
Para
el equilibrio:
el valor de Kc es 54’8 a 425ºC. Responda razonadamente:
|
|
| Solución | |
|
9’4 x = 0’6 x = 0’064
b) H2 (g) + I2 (g) D 2 HI(g) ; al añadir H2 el equilibrio se desplazará a la izda.
In 0’164 0’064 0’472 Eq 0’164 - x’ 0’064 - x’ 0’472 + 2x’
0’222 + 4x’2 +1’88x’ = 54’8 . (0’01 – 0’164x’ – 0’064x’ + x’2) 0’222 + 4x’2 + 1’88x’ = 54’8 (0’01 – 0’228x’ + x’2) 0 = 58’8x’2 – 14’38x’ + 0’326
x’ = 0’22 ® se rechaza (no puede reaccionar más de lo que hay)x’ = 0’025
|
|