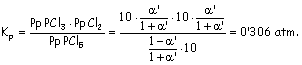| Ejercicio 2 | |
| A 200ºC y a 1 atmósfera de presión el pentacloruro de fósforo se disocia dando cloro y tricloruro de fósforo en un 48%. Calcular el grado de disociación a la misma temperatura de 200ºC pero a una presión de 10 atmósferas. Justifique el resultado obtenido. (En las condiciones del texto del problema todos los componentes son gaseosos) | |
| Solución | |
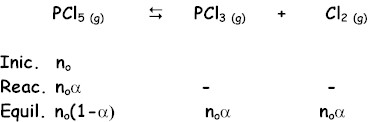
Moles totales en el equilibrio no(1-a ) + noa + noa = no( 1 + a ) Fracción molar de PCl5 : Fracción molar de PCl3 = Cl2
= Presión parcial de PCl5 = 0’347 . 1 = 0’347 atm. Presión parcial de PCl3 = PpCl2 = 0’326 . 1 = 0’326 atm.
Aplicando las mismas expresiones con a ’, el grado de disociación a 10 atm:
Soluciones: a ’ = -0’172 se rechaza a ’ = 0’172 se acepta.Al aumentar la presión y en virtud de la ley de Le Chatelier, el equilibrio tiende a compensar el aumento de presión desplazándose en el sentido en el que se formen menos moles, es decir, a la izquierda. Por eso el valor de a ’ es menor que el de a al estar el pentacloruro de fósforo mucho menos disociado. |
|