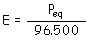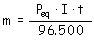Primera ley de Faraday: "La masa
de sustancia liberada en una electrólisis es directamente
proporcional a la cantidad de electricidad que ha pasado a
través del electrólito".
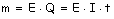
(m: masa de sustancia liberada o de
electrólito descompuesto; Q: cantidad de electricidad; I:
intensidad de corriente; t: tiempo transcurrido; E:
equivalente electroquímico (cantidad de electrólito
descompuesto o de sustancia liberada por 1 culombio de
electricidad)).
Segunda ley de Faraday:"Las
masas de distintas sustancias liberadas por la misma
cantidad de electricidad son directamente proporcionales a
sus pesos equivalentes"
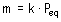
Un faraday (96.500 C) es la cantidad de
electricidad necesaria para depositar por electrólisis 1
equivalente – gramo de cualquier sustancia.