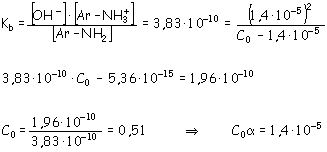| Ejercicio 21 | ||
|
La anilina es una base muy débil, con una constante de ionización de 3,83·10-10 mol/dm3. Calcule:
DATOS: C = 12, H = 1, N = 14 |
||
| Solución | ||
a)
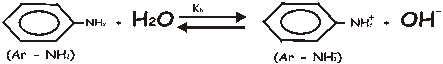
Inicio C0 _ _ Equilibrio C0 (1 - a ) C0a C0a C0 – C0a C0a = [OH -] Ţ pOH = 14 – pH = 14 – 9,14 = 4,86 pOH = - Log [OH -] = 4,86 Ţ [OH -] = 10 –4,86 = 1,4·10 –5 = C0a
b) Pm H7C6N = 93 En 0,5 litros habrá: m = 0,255 moles · 93 g/mol = 23,7 gramos de anilina.
|
||