| Ejercicio 15 | |
|
|
| Solución | |
|
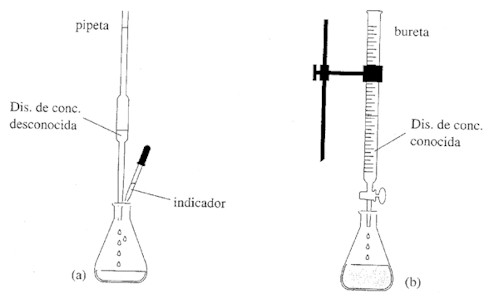
a) La forma práctica de determinar, en el laboratorio, la concentración de una disolución desconocida de ácido clorhídrico es realizar una valoración ácido – base o neutralización. Para ello, se carga una bureta con disolución de NaOH 0.1 M, enrasando bien al cero. A continuación se toma un volumen bien medido, mediante una pipeta, de una disolución de ácido, y se introduce en un erlenmeyer. Se añaden unas gotas del indicador adecuado.
Para realizar la valoración, se coloca el erlenmeyer debajo de la bureta y, abriendo la llave de paso, se deja caer gota a gota y agitando, la disolución de base, NaOH, sobre el ácido, HCl. El punto final de la valoración o punto de equivalencia se conoce por el cambio de color de la disolución, debido al indicador. b) Teniendo en cuenta que el HCl y el NaOH reaccionan mol a mol HCl + NaOH " NaCl + H2O y que por lo tanto, los moles que hay en ambas disoluciones deber ser iguales, tendremos: 0.1 M 0.025 l = [HCl] 0.030 l ] [HCl] = 0.12 M. |
|