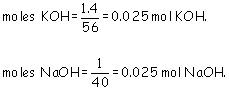| Ejercicio 14 | |
|
Se mezclan 1.4 g de hidróxido potásico y 1 g de hidróxido sódico. La mezcla se disuelve en agua y se diluye hasta 100 cc. a) Calcular el pH de la disolución. Por error, se vertió sobre la disolución alcalina 1 cc de ácido nítrico comercial de densidad 1.41 g/cc y riqueza en peso 67%. Calcular: b) La variación que se ha producido, en el pH, por la adición del ácido (considere que no se produce variación de volumen). c) La cantidad de agua que se necesita añadir a 1 cc del ácido comercial para obtener un ácido 0.5 N. d) Los cc del ácido 0.5 N que se necesitan adicionar a la disolución del apartado (b) hasta su completa neutralización. DATOS: Na = 23; O = 16; H = 1; K = 39 |
|
| Solución | |
|
a) Pm KOH = 56 g/mol y Pm NaOH = 40 g/mol. Los moles que tenemos son:
Como ambas bases son fuertes estarán completamente disociadas y tendremos: 0.025 + 0.025 = 0.05 moles de OH- en los 100 cc. Luego en un litro: [OH-] = 0.5 M. pOH = - log [OH-] = - log 0.5 = 0.30 pH = 14 – 0.30 = 13.7
b) 1 mol de HNO3 neutraliza 1 mol de OH- ya que el HNO3 es un ácido monoprótico. En 1 cc de ácido hay 0.41 0.67 = 0.945 g de HNO3 que son:
Estos neutralizan 0.015 moles de OH-. Luego quedarán 0.05 – 0.015 = 0.035 moles/100 cc que en el volumen de 1 litro será 0.35 M. Así pOH = - log 0.35 = 0.46 pH = 14 – 0.46 = 13.54 D pH = 13.54 – 13.70 = - 0.24
c) Para el HNO3 p equivalente = p mol a Normalidad = Molaridad Como 1 cc de ácido comercial contiene 0.015 moles de HNO3, el volumen para que sea 0.5 M será:
La cantidad de agua que hay que añadir sería 29 cc.
d) Como la disolución de (b) es [OH-] = 0.35 M el volumen de ácido que hay que añadir se calcula: Va Na = Vb Nb V 0.5 = 100 0.35 _ V = 70 cc. |
|