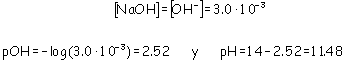| Ejercicio 12 | |
|
a) Ordenar según sea el carácter de las bases, de más fuerte a menos fuerte, las especies químicas siguientes: NH3, CH3COO- y NaOH. b) Calcular la concentración de una disolución de hidróxido de sodio que tenga el mismo pH que una disolución de amoniaco 0.5 mol dm-3. DATOS: Kb (amoniaco) = 1.8 10-5 , Ka (ácido acético) = 1.8 10-5 , Kw = 1 10-14 |
|
| Solución | |
|
Teniendo en cuenta que el NaOH es una base muy
fuerte NaOH > NH3 > CH3-COO-
b) Establezcamos el equilibrio: NH3 + H2O D NH4+ + OH- Inicio: 0.5 - 0 0 Equilibrio: 0.5 – x x x
Como el hidróxido sódico está completamente disociado, para que tenga el mismo pH:
|
|