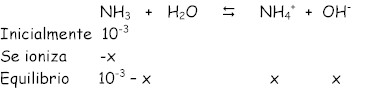| Ejercicio 6 | |
|
Halle el pH que resulta cuando a una disolución de 2 litros de amoníaco que lleva disueltos 0’17 gramos de amoníaco se añaden a 8 litros de agua.
|
|
| Solución | |
|
1’8.10-5 . 10-3 – 1’8.10-5 = x2 Û x2 + 1’8.10-5 x – 1’8.10-8 = 0 Y resolviendo la ecuación de segundo grado: x1 = 1’25.10-4 (sí vale) X2 = -1’43.10-4 (no vale)
Como x = c.a ® 1’25.10-4 = 10-3 a ® a = 0’125 (x 100) ® 12’5 % (por si nos pidiesen el grado de disociación)
[OH-] = 1’25 . 10-4 pOH = - Log 1’25.10-4 = 3’9 pH = 14 – pOH = 14 – 3’9 = 10’1 (básico) |
|