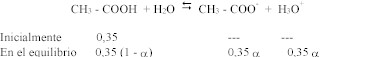|
Ejercicio 3
|
|
|
El ácido acético
puro es, en condiciones ordinarias de presión y temperatura, un líquido
cuya densidad es 1,05 g/mL.
-
Calcule
el grado de disociación del ácido acético en una disolución
preparada a partir de 10 mL de ácido acético y llevada hasta
500 mL de volumen final.
-
Calcule
el pH de un vinagre, de densidad 1,01 g/mL que contiene el 5 %
en peso de ácido acético. Suponga que el vinagre está
constituido exclusivamente por ácido acético y agua.
Pm Ac. acético
60,05 y su Ka = 1,8.10-5 mol/L
|
|
|
|
Solución
|
a)
Masa de acético que se toma: 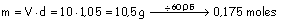
Como el volumen final es de 0,5 L, en un litro
habrá el doble de moles, luego la concentración
será 0,35 molar. Con esta concentración de
partida:
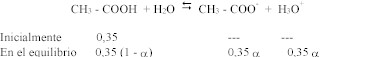
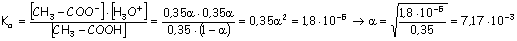
a
= 0,0072

b)
Masa de 1 litro de vinagre:
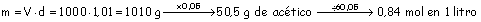
Siguiendo
el mismo procedimiento que en el apartado anterior, obtendríamos:
a ' = 0,0046 y [H3O+]
= 3,9.10-3 ® pH
= 2,4
|
|