
Fig. 1 Adulto recién emergido de Ctenarytaina eucalypti (Maskel)
INTRODUCCION
Los psílidos o piojos saltarines se asemejan a diminutas cigarras, miden de largo entre 1 a 10 mm. Forman parte de la superfamilia Sternorryncha en donde sus miembros son exclusivamente succionadores de savia de las plantas, salvo pequeños grupos que comen monocotiledóneas y coníferas; son generalmente monófagos u oligófagos en su estado ninfal, a diferencia de las especies de Aleyrodoidea (mosquitas blancas) que es una familia muy cercana a los psílidos.
La mayoría forman agallas en los brotes o las partes florales. Su reproducción es bisexual, excepcionalmente se presenta la partenogénesis. Se han descrito unas 3000 especies estimando un total de 8000 especies.
Los psílidos se distribuyen desde las zonas bajas hasta los Alpes, presentando una extensa diversificación y especialización en todas las plantas cultivadas y ornamentales entre otras.
La ordenación de los psílidos
en diferentes grupos se ha hechos desde Linnaeus (1758), para luego continuar
con Förster (1848), posteriormente Flor (1861), quien fue el primero
en utilizar la genitalia como caracter para definir especies, Luego en
la segunda mitad del siglo XIX el Austriaco, Low y Crawford (1914) presentaron
una nueva agrupación, lo que se vio modificado por Bekker-Migdisova
(1973). En los últimos años se ha logrado reunir una vasta
cantidad de material desde los trópicos y el hemisferio Sur. En
la actualidad con nuevas ideas de filogenia para los psílidos han
trabajo en la fauna del hemisferio sur Hollis (1976, 1984, 1987), White
& Hodkinson (1985), Burckhardt (1987 a, b). De acuerdo a estos autores
la superfamilia Psylloidea se compone de seis familias Psyllidae,
Calophyidae, Phacopteronidae, Carsidaridae y Homotomidae.
Algunas familias de plantas son particularmente
importantes como las Fabaceae, Asteraceae, Chenopodiaceae y Myrtaceae,
las especies de psílidos tienden a encontrarse asociadas a taxa
de plantas, como el complejo de Trioza sobre Berberis sp,
o miembros del grupo Notophorina sobre especies de Nothofagus
spp. o la numerosa tribu australiana Spondyliaspidini esta restringida
casi exclusivamente a Myrtaceae.
POSICIÓN DE LOS PSYLLOIDEA EN EL SISTEMA DE HEMIPTERA
El orden Hemiptera forma un grupo bien definido dentro de los Paraneopteras (Psocoptera, Pthiraptera, Hemiptera y Thysanoptera) de los Hemimetábolos (metamorfósis incompleta ( huevo-n1-n5, adulto), alados o secundariamente ápteros).
El orden Hemiptera se caracteriza por partes bucales horadadoras y chupadoras que forman un rostrum. Las partes bucales están modificadas para formar dos pares de estiletes esclerosados (estiletes mandibulares y estiletes maxilares), flexibles, extendidos en una ranura anterior en el labio de uno a cinco segmentos (rostrum)
Los estiletes mandibulares son laterales a los estiletes maxilares. Las ranulas longitudinales (internamente) de cada estilete maxilar forman un canal salivario posterior y un canal de alimentación anterior entre estiletes opuestos. Los estiletes se articulan dentro de la cabeza.
Los Psylloidea presentan adultos pequeños, procesos genales desarrollados, antenas con 10 segmentos, tres ocelos, estiletes alojados en la crumena internal, patas posteriores saltatorias, coxas largas, fijadas, trocanteres condilados, espinas saltatorias en el ápice de la tibia y primer segmento tarsal. R, M y Cu de cada ala anterior generalmente con ramificación simple, vena periferal presente, clavus presente, proctiger bien desarrollado, anillos circunanal de glándulas cerosas presente en la hembra. Sexos similares, reproducción bisexual.
Ninfas no saltoriales, aplastadas dorsoventralmente, cabeza y protórax fusionados, estiletes alojados externamente en la base del labium, cojinete del ala anterior frecuentemente producido como un lóbulo humeral. Tibia y tarsos fusionados en los estados I-IV y unisegmentados en el estado final (V), arolium bien desarrollado, generalmente presente. La producción de cera es común, secretada mayoritariamente por la base de las setas lanceoladas o sectasetae en el abdomen. las ninfas de la mayoría de los Spondyliaspininae construyen escamas Las escamas son construídas por la excreta anal (mieloso) y tiene un alto contenido de carbohidratos.
Los huevos son pedunculados, parecidos a los de los Aleyrodidae, el pedúnculo es insertado en el tejido de la planta , desde el cual absorbe agua.
El ataque masivo ha sido registrado en algunas especies de géneros de la subfamilia Spondyliaspininae como Cardiaspina y Glycapsis resultando el debilitamiento del hospedero y necrosis de la hoja.
Las especies de Ctenarytaina, Blastopsylla y Acizzia han sido accidentalmente introducidas, presumiblemente a través de la importación de Eucalyptus y Acacia.
Los Spondyliaspininae incluyen 10 géneros
constructores de agallas en Eucalyptus. Glycapsis (140 sp.)
es el más grande. Las especies de vida libre colonizan ramas de
Eucalyptus y algunas Myrtaceas.
El género Ctenarytaina Ferris & Klyver tiene 25 especies conocidas.
Diagnosis: presenta cabeza grande,
más ancha que el mesonotum, cercanamente vertical al eje del cuerpo,
vértice deprimido discalmente, fuertemente abultado y redondeado
anteriormente por abajo, curvando suavemente los procesos genales sin sutura
diferenciada, lóbulo pequeño del esclerito ocular entre el
ojo y la base de la antena. Proceso genal corto, romo, contigua o separado,
ojos... más o menos alargados, antena largo como el ancho de la
cabeza, tórax ancho, corto y completamente aplastado dorsalmente,
pronotum muy ancho como el mesonotum. Alas anteriores largas, delgadas,
redondeadas apicalmente, membrana algo engrosada, retesiosa, quebrada en
la costa en la base del engrosamiento pterostigmal; pterostigma con o sin
una notable vena marginal, larga, delgada; vena basal extremadamente corta,
medial y cubital con un peciolo común; Rs muy larga, estrecha hasta
casi el ápice, casi alcanzando el ápice del ala; medial larga,
estrecha a pequeña, amplia celda al ápice del ala; cubital
corta, celda cubital mas bien grande, más grande que la celda medial;
Cu1 más o menos paralela a la medial y Rs. Patas de moderado tamaño.
Mesotibia con un peine preapical de pequeñas setas. Metacoxa con
un prominente, alargado y romo meracanthus. Metatibia con varias setas
prominentes negras en el ápice.Segmento proximal del metatarsus
con pequeñas uñas. (Tuthill & Taylor, 1955).
CTENARYTAINA
EUCALYPTI (MASKELL, 1890)
COMBINACION: Rhinocola eucalypti Maskell

Fig. 1 Adulto recién
emergido de Ctenarytaina eucalypti (Maskel)
ADULTO HEMBRA: color general púrpura
oscuro, casi negro, largo del cuerpo alrededor de 1.5 mm., visto dorsalmente
la cabeza y el tórax de un púrpura oscuro, las alas amarillas,
color blanco harina en el tórax, abdomen púrpura oscuro,
bandeado transversalmente con amarillo, antenas amarillas, tornando a negro
en el ápice, genitalia negra, ojos castaño-oscuro, prominente,
alas membranosas, blancas grisáceas, venas amarillas, vista ventralmente,
cabeza y tórax púrpura, patas amarillo-oscuras, cabeza más
ancha que larga, deprimida en la frente y prolongada en dos cortos conos
genales redondeados, rostrum corto, cilíndrico, llevando tres setas.
Alas anteriores alargadas, alrededor de dos y media vez el ancho. Alas
posteriores alargadas, anchamente redondeadas en el ápice.
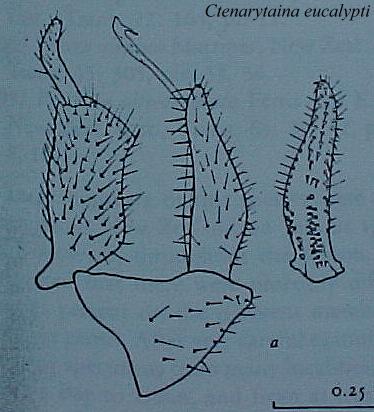
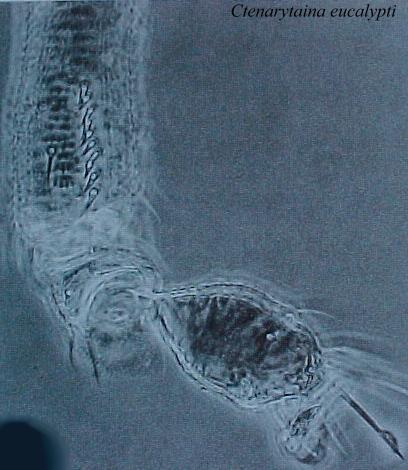
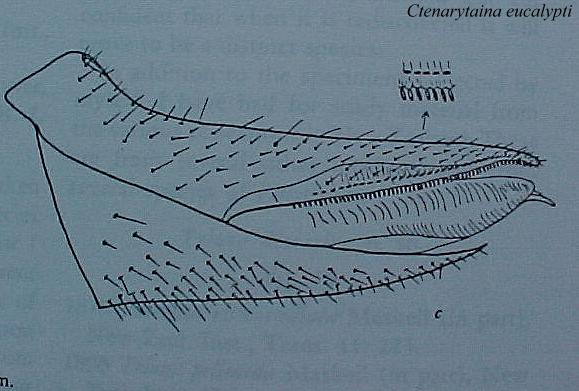
Fig. 2 . Genitalia macho de Ctenarytaina eucalypti (Maskell) (ex: Tuthill, 1952)
Fig. 3. Metatibia con la corrida de espinas en Ctenarytaina eucalypti (Maskell)
(ex: Burckhardt, 1999)
Fig. 4. Genitalia hembra de Ctenarytaina eucalypti (Maskell) (ex: Tuthill, 1952)
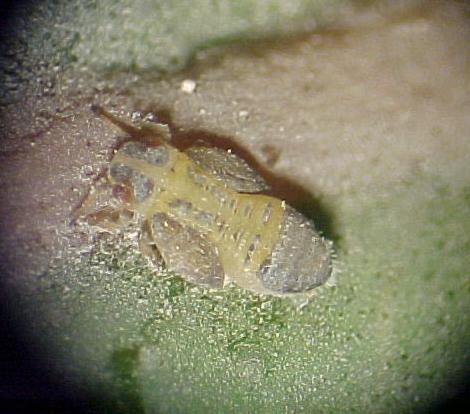
Fig. 5 Ninfa de V estadio de Ctenarytaina eucalypti (Maskell)
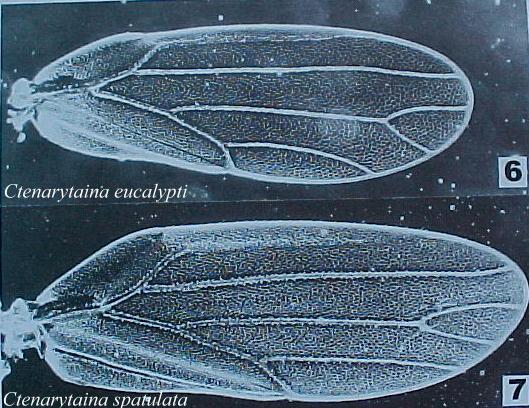
Fig. 6. Ala anterior de Ctenarytaina eucalypti (Maskell) (ex: Burckhardt, 1999)
Fig.7 Ala anterior de Ctenarytaina spatulata Taylor (ex: Burckhardt, 1999)
La hembra coloca de 20 a 100 huevos en las
ejes de las hojas juveniles, pequeñas ramas o en las yemas. El desarrollo
toma un mes (en Portugal) cuando las condiciones son óptimas; en
una incubación a 20º C, y 12 días aparece la primera
ninfa y luego hasta completar el adulto demora entre 5-9 días (Sur
de Australia).
Existen cinco estadios ninfales que se distinguen
principalmente por el desarrollo de las alas o mejor llamados pterotecas
(pteros: ala; tecas: lo que envuelve al ala).
Parásitos: Eulophinae: Pteroptrix maskelii
Ichneumonidae: Syrphoctonus cf. abdominalis
Depredadores: Syrphidae: Eumerus sp.; Melliscaeva cictellus; Pipizella sp; Sphaephoria scripta.
Sciaridae: Bardysia sp.
Tabanidae: Haematopoda ocelligerg
De los enemigos naturales encontrados
en el país se encuentra un Syrphidae del género Pipiza sp.
del cual se han encontrado la larva, pupa y probablemente el adulto.

8. Adulto del Syrphidae asociado a Ctenarytaina
eucalypti (Maskell)


9-10. Larva de Syrphidae asociado a Ctenarytaina
eucalypti (Maskell)


11-12. Pupa de Syrphidae asociado a Ctenarytaina
eucalypti (Maskell)

Fig. 13. Fauna acompañante.
| BOLIVIA | Hollis (in Hodkinson, 1999 (com. per.)) |
| BRASIL | Burckhardt et al, 1999 |
| COLOMBIA | Hollis (in Hodkinson, 1999 (com. per.)) |
| IRLANDA | Hodkinson & White, 1979 |
| FRANCIA | Mercier & Poisson, 1926; Martínez, 1983, Bertaux et al, 1996 |
| ALEMANIA | Burckhardt, 1998 |
| ITALIA | Cavalcaselle, 1982 |
| NUEVA ZELANDA | Frogatt, 1903; Tuthill, 1952. |
| PAPUA; NUEVA GUINEA | Hodkinson, 1983 |
| PORTUGAL | Nogueira, 1951; Azevedo & Figo, 1979; Burckhardt, 1998. |
| SUDAFRICA | Pettey, 1925; Stuckenberg, 1961; Capener, 1970. |
| ESPAÑA | Rupérey & Cadahia, 1973; Cadahia & Rupérey, 1979; Cadahia, 1980. |
| SRI LANKA | Azevedo & Figo, 1979. |
| REINO UNIDO | Lain, 1922; Fox-Wilson, 1924; Hodkinson & White, 1979. |
| ESTADOS UNIDOS (California) | Dahlsen et al., 1993 |
El género Ctenarytaina Ferris & Klyver se caracteriza por la presencia de un peine de cerdas en la parte apical externa de la mesotibia. Las diferencias con respecto a otras especies son:
- Cabeza y tórax castaña oscura a negra.
- Alas anteriores blanquizcas oscuras contrastando con las venas castañas.
-Vértice 1.5 veces tan ancho como largo, antero lateralmente débilmente cóncavo.
-Tubérculo preocular aplastado.
- Ojos semiesféricos
- Alas anteriores uniformemente redondeadas apicalmente.
-Vena C + Sc uniformemente, suavemente curvado.
-Vena Cu1b uniformemente, curvado apicalmente.
-Mesotibia con una hilera preapical en forma de cepillo.
-Metacoxa con un meracanthus romo, prominente y alargado.
-Genitalia del macho con un proctiger alargado, cuadrangular en la base y luego una prolongación roma.
-Placa subgenital subcuadrangular, paramero alargado, casi 2/3 el largo del proctiger, -presenta gran cantidad de setas centrales y laterales.
-Genitalia de la hembra con placa subgenital
y proctiger alargado,a l menos 7 veces el ancho del anillo circunanal,
gran cantidad de setas , presencia de pequeñas setas en el contorno
del proctiger.
ESTADOS INMADUROS
HUEVO: Colocados en grupos en número de 20- 100 huevos por cada hembra, de color amarillo, adosados a los tallos a través de una sustancia sementante.
NINFAS: El número total de ninfas a través del desarrollo hasta el estado adulto son en número de cinco.
NINFA 1 se caracteriza por ser inmóvil, de ojos rojos, cuerpo amarillo, sin presencia de pterotecas, tibia y tarso fusionados.
NINFA 2 se caracteriza por presentar movimiento, es de color amarillo de ojos rojos, presencia de setas alrededor del cuerpo, ausencia de pterotecas, tibia y tarso fusionados.
NINFA 3 se caracteriza por el comienzo del desarrollo de las pterotecas, el color es amarillo con manchas púrpuras , tibia y tarso fusionados.
NINFA 4 presenta gran desarrollo de las pterotecas, tibia y tarso fusionados.
NINFA 5 desarrollo completo de las
pterotecas, gran movimiento, tibia y tarso unisegmentados.
BIBLIOGRAFIA
BURCKHARDT, D. 1993. Psílidos (Homoptera, Psylloidea) en cultivos y plantas ornamentales de climas templados y subtropicales. Servicio Agrícola y ganadero. Proyecto de modernización. Departamento de protección agrícola. Mimeografiado. 67 pp.
BURCKHARDT, D. 1994. Generic Key to chilean jumping plant-lice (Homoptera: Psylloidea) with inclusion of potencial exotic pest. Rev. Chilena. Ent. 21: 57-67.
BURCKHARDT, D. 1994. Psylloid pest of temperate and subtropical crop and ornamental plants (Hemiptera: Psylloidea): a review. Entomol. (Trends in Agril. Sci).2: 173-186.
BURCKHARDT, D., D. L.Q. SANTANA, A.L. TERRA, F.M. DE ANDRADE, S. PENTEADO, E. IEDE & C. MOREY.1999. Psyllids pest (Hemiptera: Psylloidea) in South American eucalypt plantations. Bulletin de la Societé Entomologique Suisse. 72: 1-10.
BURCKHARDT, D., M. ELGUETA. 2000. Blastopsylla occidentalis Taylor (Hemiptera: Psyllidae), a new introduced eucalypt pest in Chile. Rev. Chilena. Ent. 26. 57-61.
CSIRO, 1991. The insects of Australia. In: Carver, M., F. Gross & T.E. Woodward Hemiptera. 429-509.
HODKINSON, I. 1999. Biocontrol of eucalyptus psillid Ctenarytaina eucalypti by the australian parasitoid Psyllaephagus pilosus: a review of current programmes and their success. News and Information 20(4): 129N-134N.
MASKELL, W.M. 1890. On psyllidae in new Zealand. Transactions of the New Zealand Institute. 22: 157-168.
MORGAN, F.D. Psylloidea of South Australia. Handbook of the Flora and Fauna of New South Wales. Handbooks Committee South Australian Government. 136 pp
OLIVARES, T. S. 2000. Ctenarytaina eucalypti (Maskell 1890): el psilido del eucalipto en Chile (Hemiptera: Sternorryncha: Psylloidea: Spondyliaspininae). Gayana 64(2): 239-241.
SANDOVAL, A. Nueva plaga de los eucalyptos. Revista del campo. El mercurio.
SERVICIO AGRICOLA Y GANADERO. 2000. El psílido de los eucaliptos Ctenarytaina eucalypti Maskell (Hemiptera: Psyllidae). Ministerio de Agricultura. Departamento de Protección Agrícola. Subdepartamento de Vigilancia Fitosanitaria. Triptico.
TUTHILL, L.D. On the Psyllidae of New Zealand. 1952. Pacific Science 6: 83-125
TUTHILL, L.D. & K.L. TAYLOR.1955. Australian genera of the family Psyllidae (Hemiptera, Homoptera). Australian Journal of Zoology. 3(2): 227-257.
ZONDAG, R. 1982. Ctenarytaina eucalypti
(Maskell) (Hemiptera: Psyllidae). Forest and Timber insects in New Zealand.
53: 4 pp.
GLOSARIO
AGALLAS: un crecimiento anormal en el tejido de las plantas causado por varios organismos, la cual irrita la planta y posiblemente la conducen a la producción de algun tipo de hormona de crecimiento.
ANILLO CIRCUNANAL: en psyllidae, es un anillo de poros circumanales.
EPIMERON: división posterior del pleurón torácico.
EPISTERNUM: esclerito anterior del pleurón.
ESCULTURA: las marcas o patrones de impresiones o elevaciones en la superficie.
ESPINAL GENAL: espina ubicada en la articulación femorotibial.
ESPINULAS (sing. SPINULA; pl. SPINULAE): crecimiento cuticular delgado externo donde falta inervación.
ESPINULAS RADULARES: en psílidos, protuberancias cuticulares pequeñas apareciendo en forma un ramillete en forma de V en las celdas alrededor del márgen apical o anal del ala.
ESPOLÓN SALTATORIAL: apéndice cuticular acolchado o espina conectada a la pared corporal por una juntura generalmente en la tibia.
FOVEA DISCAL: cavidad discal
GENAE: la parte del cráneo en cada lado bajo el ojo.
MERACANTHUS: en algunos psílidos, diferenciable, cónico, proyección posterior de la coxa posterior.
METACOXA. Coxa posterior.
METAFEMORA: fémur posterior
METATIBIA: tibia posterior.
NINFA: estado inmaduro de insectos hemimetábolos.
OCELLI LATERAL: STEMMATA (sing. STEMMA) ojos simples, generalmente circular, grupo de ojos laterales en larvas holometábolas, pequeños tubérculos nacidos por las antenas.
OCELLI MEDIANO: en insectos adultos, el ojo simple consiste en un simple lente, en forma de cuentas de rosario, apareciendo simples o en pequeños grupos, en larvas holometábolas.
OCCIPOCCIO: parte posterior del epicráneo entre el vértice y la nariz estando raramente presente un esclerito diferenciable, parte dorsal de la cabeza entre el sulcus occipital y el sulcus postoccipital.
ORTOGNATO: HYPOGNATO: teniendo la cabeza vertical y la boca directamente ventral, la mayoría de los LEPIDOPTERA exofagus y larvas de Hymenoptera.
PARAMERO: en machos de psílidos, tenazas.
PLACA SUBGENITAL: en insectos adultos, una
placa bajo la genitalia del esternito
abdominal IX (noveno)
PROCESOS GENALES: extensión posterior de la gena, frecuentemente terminando en forma de punta.
PROGNATO: teniendo la cabeza horizontal con los.. directamente hacia afuera.
PRONOTUM: parte más baja y dorsal del protórax.
PROPLEURITES: pleurón del tórax.
PTEROSTIGMA: una mancha pigmentada o celda en el margen anterior del ala, generalmente cerca o justo debajo del ápice de la vena R1, llevando el mayor volumen que un área equivalente del área adyacente, por esa inercia influenciando el movimiento en el cual la membrana del ala durante el vuelo.
QUETOTAXIA: la ordenación y nomenclatura de las setas o hileras en cualquier parte del exoesqueleto de un insecto o el estudio de como se ordenan.
QUIEBRE COSTAL: un punto en la vena costal (C) donde la esclerotización es débil o falta o la vena parece estar quebrada.
RHINARIA (sing. RHINARIUS): sensorium primario
SETA (pl. SETAE): proyección de la cutícula en forma de pelo esclerosado, llevando desde una célula tricógena simple y subredondeada en la base por un pequeño anillo cuticular.
STERNORRYNCHA: división entre los hemipteros, poseen tarsos con al menos tres segmentos (tarsómeros) y ocelos anteriores cuando están presentes, con o sin pocas celdas cerradas.
SUTURA CORONAL: en los insectos adultos, la parte medial impar de la sutura epicraneal.
TORULI (sing. TORULUS): soquete basal de la antena.
VALVULAS: cubierta para una abertura, la cual abre en una dirección y cierra en la otra dirección.